/ 专家共识/
子宫内膜癌超声造影中国专家共识
Chinese experts consensus on contrast-enhanced ultrasound in endometrial cancer
作者信息
中国医师协会超声医师分会
何 文(通信作者)
首都医科大学附属北京天坛医院超声科
陈绍琦 (执笔人 通信作者)
汕头大学医学院第一附属医院超声科
摘要
为进一步普及、规范和推广超声造影(CEUS)在子宫内膜癌(EC)中的临床应用,中国医师协会超声医师分会组织相关专家进行多次会商,参考国内外文献,结合自身实践经验,围绕CEUS在EC中的应用价值及其方法共同确立本共识。
Abstract
To further popularize, standardize and promote clinical application of contrast-enhanced ultrasound (CEUS) in endometrial cancer (EC), Ultrasound Doctor Branch of Chinese Medical Doctor Association organized a number of meetings and discussions with relevant experts to jointly establish this consensus through reviewing relevant literature at home and abroad and combining with their practical experiences, mainly focused on the application value and methods of CEUS in EC.
子宫内膜癌(endometrial carcinoma, EC)是女性生殖系统常见三大恶性肿瘤之一[1],近年在我国发病率呈上升趋势[2]。相比常规超声检查,超声造影(contrast-enhanced ultrasound, CEUS)可清楚显示子宫内膜微循环灌注特征,且能准确评估病变浸润肌层深度[3-4],为诊断EC提供更丰富、客观的影像学信息[5-6];但目前对于CEUS用于诊断EC的标准检查方法及诊断要点缺乏共识。中国医师协会超声医师分会组织相关专家,参考国内外文献,结合自身实践经验,通过反复会商形成本共识(国际实践指南注册与透明化平台注册号:PREPARE-2023CN086),以规范EC CEUS检查方法,提高我国EC CEUS应用水平。本共识参考牛津循证医学中心制定的证据等级标准划分证据等级(level of evidence, LOE)和推荐级别(class of recommendation, COR)。
1
适应证
常规超声发现局灶性或弥漫性子宫内膜异常而疑诊EC时,可行CEUS协助明确诊断或观察EC肌层浸润范围、程度[7]。
2
检查前准备
2.1超药品说明书用药备案 目前临床可用造影剂包括声诺维(SonoVue)、示卓安(Sonazoid)、雪瑞欣和力达星等;本共识以声诺维为例。2022年声诺维最新版使用说明书所列适应证尚未涵盖生殖系统疾病,故在开展EC CEUS前应向医疗机构相关部门申请并备案。
2.2知情同意 检查前需确认患者无CEUS禁忌证,与患者或家属详细说明超药品说明书用药的检查目的及风险,并使其在同意后签署《超药品说明书用药知情同意书》。
2.3 仪器与药品 具备造影功能的彩色多普勒超声诊断仪、腔内探头、凸阵探头、造影剂、生理盐水以及复苏设备等。
3
检查方法
3.1 检查途径 首选经阴道检查;病灶范围超出国际妇产联盟(International Federation of Gynecology and Obstetrics, FIGO)ⅢC期时[8],以之联合经腹部检查。对无法行经阴道检查者可经腹部检查;如若病灶显示不清,可联合经直肠检查[9](LOE:2a,COR:B)。
3.2 造影剂剂量 经腹部CEUS推荐造影剂剂量为1.2~1.6 ml,经阴道或经直肠CEUS推荐剂量为1.5~2.4 ml(LOE:5,COR:D)。
3.3 检查条件 经阴道或经直肠CEUS:腔内探头频率2.0~9.0 MHz,造影频率谐波(harmonic)3.5~4.0 MHz,机械指数(mechanical index, MI)0.070~0.088,将焦距带(focal zone)置于病灶底部水平,动态范围(dynamic range)100~110 dB,帧频(frame rate)10~15 FRS。经腹部CEUS:凸阵探头频率1.2~6.0 MHz,造影频率谐波1.8~2.2 MHz,MI 0.072~0.086,将焦距带置于病灶底部水平,动态范围100~110 dB,帧频10~15 FRS[7,10]。可根据实际情况对上述参数加以调整。
3.4 检查流程 造影前应先行常规超声扫查,包括灰阶超声、彩色多普勒及频谱多普勒超声。
CEUS步骤:①将切面固定于病灶区域,切换至CEUS模式,调节造影条件;②注射造影剂并开始计时,连续存储3 min内的动态图像[6,11](LOE:2b,COR:B)。
3.5 技术要点
3.5.1 常规超声 应对子宫、双侧附件及盆腔其他脏器进行多切面扫查,仔细观察内膜整体情况,探测病灶处血流信号,发现粗大供血血管时,测量其收缩期峰值流速、舒张末期流速及阻力指数;通过观察内膜基底层情况初步判断病灶浸润肌层深度。
3.5.2 CEUS 造影前先以灰阶超声选择子宫正中矢状切面,而后应用彩色多普勒超声进行调整,以清晰显示病灶粗大供血血管的切面作为初始观察切面;必要时可在首次造影结束至少10 min后行第2次造影,选择显示病灶粗大供血血管的横切面进行观察[10,12](LOE:2b,COR:B)。
4
EC常规声像图特征
灰阶声像图中,EC表现为子宫内膜弥漫性或局灶性增厚,回声不均;累及肌层时,内膜与肌层分界不清,受累肌层呈不均匀低回声,与周围正常肌层无明显界限。EC彩色多普勒及频谱多普勒均无特异性表现,在前者可呈富血供型或乏血供型,也可正常分布,在后者可表现为高阻力、中等阻力及低阻力血流频谱[12]。
5
CEUS观察EC
CEUS可清楚显示子宫内膜病变的微循环特征,提供更丰富的血流灌注信息,以协助诊断EC[13-17](LOE:1a,COR:A)。
5.1 时相 EC CEUS可分为增强早期和增强晚期,前者指子宫动脉开始灌注至子宫肌层完全灌注并逐渐增强达峰的过程,晚期指子宫肌层到达峰值强度后消退至造影前水平的过程。
5.2 观察指标
5.2.1 增强时间 增强时间指自注入造影剂至观察目标内造影剂开始显影的时间。以正常子宫肌层为参照,早之为早增强,与之同时增强为同步增强,晚之为迟增强。
5.2.2 增强水平 以正常子宫肌层为参照,观察目标内造影剂灌注显影强于子宫肌层为高增强,与之等同为等增强,低于子宫肌层为低增强;无造影剂显影为无增强。病灶增强水平不一致时,以增强最明显部分为准。
5.2.3 造影剂分布 分为均匀分布和不均匀分布。
5.3 增强特征 EC早期多无异常灌注。随病变进展,病灶出现明显灌注异常:在增强早期,局灶性病灶呈早增强,达峰时呈均匀或不均匀高增强(图1);弥漫性病灶呈同步增强或早增强,达峰时呈不均匀高或等增强(图2);病灶浸润子宫肌层时,子宫内膜与受累肌层分界不清,增强后病灶范围扩大。在增强晚期,病灶呈相对低增强,与周围正常肌层分界清晰。病灶内存在坏死或液化时,相应区域全程无增强。
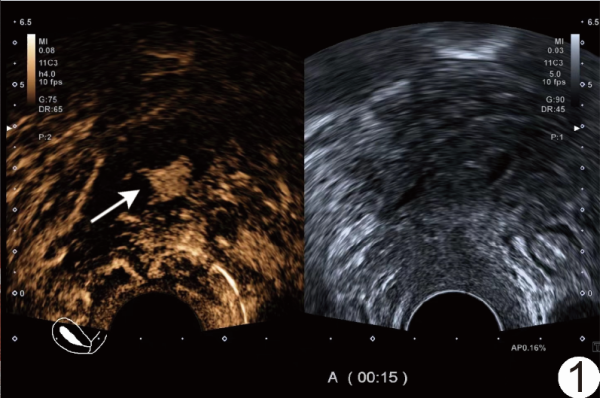
图1 患者女,69岁,EC 经阴道CEUS图示增强早期局限性病灶(箭)快速显影,明显早于周围正常肌层,呈均匀高增强,与周围肌层分界清晰
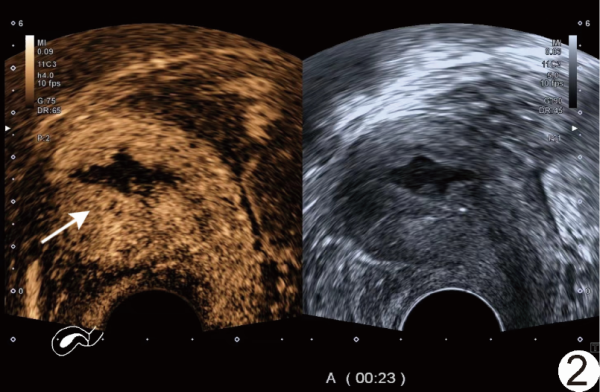
图2 患者女,58岁,EC 经阴道CEUS图示增强早期弥漫性病灶(箭)呈同步不均匀等增强,与肌层分界不清
5.4 评估EC肌层浸润深度 术前评估EC肌层浸润深度对预测淋巴结转移[18]、拟定治疗方案、评估预后及随访具有指导意义[19]。CEUS能比常规超声更好地显示EC对周围肌层的浸润深度及侵犯宫颈情况[6,15,20]。增强早期EC病灶和周围部分未受累肌层可出现一致性增强,导致评估肌层浸润深度过高;增强晚期所示病灶范围与其实际范围相近,且EC呈相对低增强,与周围肌层界限相对更清晰(图3),故此时评估EC肌层浸润深度和宫颈是否受侵(图4)的准确性更高[21](LOE:2b,COR:B)。
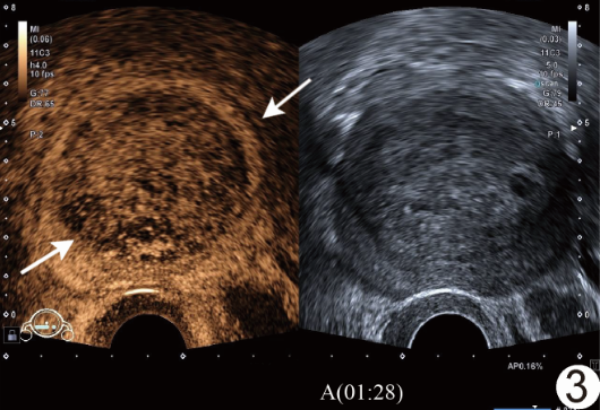
图3 患者女,60岁,EC 经阴道CEUS图示增强晚期病灶(箭)内造影剂消退早于周围正常肌层,呈相对低增强,与周围子宫肌层分界清晰
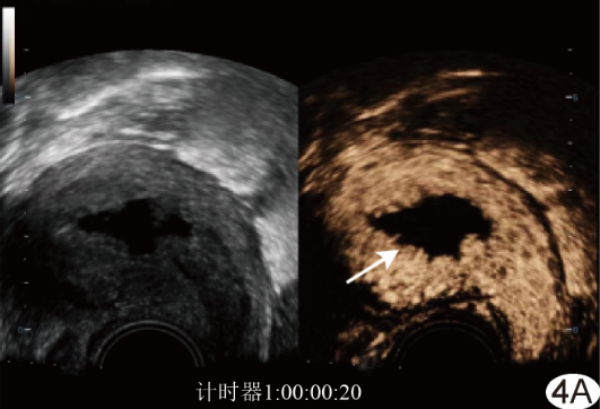
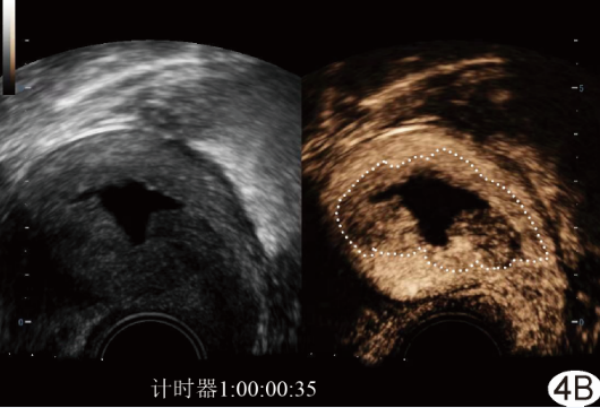
图4 患者女,58岁,EC A.经阴道CEUS图示增强早期病灶呈不均匀等增强,与周围肌层界限欠清,宫腔内无回声区为积液(箭);B.注入造影剂后35 s,经阴道CEUS图示病灶浸润子宫肌层和宫颈,病灶内(白线内)造影剂消退较快,呈相对低增强,与周围未受累肌层界限清晰
6
EC CEUS时间-强度曲线定量分析
6.1 绘制时间-强度曲线(time-intensity curve, TIC)方法 将探头固定于病变区域,全程记录造影灌注过程[7]。造影结束后于病灶及其周围子宫肌层选取大小、形状一致的ROI,绘制TIC,获取对应定量参数。
6.2 相关参数 包括病灶开始增强时间(arrival time, AT)、达峰时间(time to peak, TTP)、峰值强度(peak intensity, PI)及曲线下面积(area under the curve, AUC)等。AT指自注射造影剂至ROI内开始出现增强的时间;TTP指ROI开始增强至增强达到峰值的时间;PI为ROI内增强强度最显著时的信号强度;AUC为造影过程中ROI的时间-强度曲线下面积。
6.3 EC的TIC特征 与内膜良性病变及未受累子宫肌层相比,EC病灶AT、TTP较短,PI、AUC较大。
6.4 临床价值 TIC定量分析有助于鉴别子宫内膜良、恶性疾病[3,22]。病灶与肌层增强时间或水平差别不显著时,肉眼常难以识别;TIC可通过量化ROI内造影剂灌注随时间变化而呈现病灶与肌层的增强差异,有助于降低主观因素对评估结果的影响,更客观地反映病灶增强特征。以CEUS定性分析联合TIC定量分析可进一步提高诊断及鉴别诊断的准确性。需要注意的是,TIC定量参数易受图像质量及ROI取样误差的影响[3]。
7
声像图储存要求及报告书写规范
7.1 声像图储存要求 常规超声需保留子宫正中矢状切面及横切面灰阶声像图、病灶显示最大纵切面及横切面的灰阶声像图,以及病灶彩色多普勒及频谱多普勒图像;对CEUS需以双幅图像对照格式保留病灶增强早期和增强晚期图像。
7.2 检查报告书写内容 常规超声需描述子宫位置、形态、大小,子宫肌层回声,内膜厚度及回声,病灶位置、大小、形态、边界、内部回声及血流等。CEUS需描述造影检查途径、所用造影剂名称、注射方式、注射次数及剂量,并按照时相顺序重点描述病灶增强模式;应描述病灶在增强早期的增强时间、增强水平、造影剂分布特征,以及病灶在增强晚期的消退时间和增强水平,最终给出超声诊断提示。EC CEUS检查报告模板示例见图5。

图5 EC CEUS检查报告模板示例
8
CEUS不良反应及防治措施
8.1 不良反应 声诺维安全性较高,不良事件发生率低[23]。不良反应可分为过敏反应和血管迷走反应。轻度不良反应包括局部荨麻疹、皮肤水肿、恶心、头痛等;中度不良反应可出现皮肤弥漫性红斑、面部水肿、喉咙发紧、持续恶心呕吐、高血压急症等;重度不良反应包括呼吸困难、严重缺氧、过敏性休克、惊厥及癫痫等。
8.2 防治措施 检查室须配备急救设备与急救药品。造影过程中应进行密切医学观察。对于轻度不良反应无需特殊处理;对较严重不良反应,应根据其症状采取相应的对症治疗;基本治疗措施包括维持静脉通道、监测生命体征、监测脉搏氧饱和度、面罩吸氧、抬高下肢>60°及快速输注1 000 ml生理盐水等。对严重荨麻疹可给予组胺H1受体阻滞剂;对支气管痉挛可予β2受体激动剂气雾剂。对严重过敏反应患者应静注1.0~3.0 ml(1∶10 000)肾上腺素,可重复给药,总量不超过1 mg。严重血管迷走反应致心率减慢时,应缓慢静注0.5~1.0 mg阿托品并以生理盐水冲管,可重复给药,总量不超过3 mg。
9
总结
声诺维为血池造影剂,以之行CEUS主要依靠微循环特征判断病灶性质。早期EC多无灌注异常,CEUS表现与子宫内膜增生相似。随着病程发展,EC病灶出现明显灌注异常,根据其CEUS特征性表现可与子宫内膜良性病变相鉴别。在评估肌层浸润深度方面,CEUS可更清晰显示病灶与子宫肌层的分界,更准确地评估肌层浸润深度;但体积较大的局灶性EC病灶可致宫腔变形,使子宫肌层受压、变薄,导致高估肌层浸润深度。因此,以CEUS对EC进行诊断和术前评估时,应充分了解其优势及局限性。
本共识将持续进行完善和优化,期待未来可获得更多更高等级循证证据。
专家组成员
主持人
何文(首都医科大学附属北京天坛医院)
陈绍琦(汕头大学医学院第一附属医院)
专家组成员(按姓名拼音排序)
陈绍琦(汕头大学医学院第一附属医院)
戴晴(中国医学科学院 北京协和医学院 北京协和医院)
何文(首都医科大学附属北京天坛医院)
郭燕丽(中国人民解放军陆军军医大学第一附属医院)
黄瑛(中国医科大学附属盛京医院)
栗河舟(郑州大学第三附属医院)
罗红(四川大学华西第二医院)
罗渝昆(中国人民解放军总医院第一医学中心)
孙立涛(浙江省人民医院)
张巍(首都医科大学附属北京天坛医院)
张盛敏(宁波市第一医院)
朱江(浙江大学医学院附属妇产科医院)
参考文献
[1] SIEGEL R L, MILLER K D, WAGLE N S, et al. Cancer statistics, 2023[J]. CA Cancer J Clin, 2023,73(1):17-48.
[2] 孙可欣,郑荣寿,佐晶,等.2015年中国子宫内膜癌发病和死亡情况分析[J].中华医学杂志,2022,102(26):1987-1992.
[3] TONG X, WU X, ZHANG Q. Value of preoperative staging of endometrial carcinoma with contrast-enhanced ultrasonography: A PRISMA compliant meta-analysis[J]. Medicine (Baltimore), 2021,100(14):e25434.
[4] GREEN R W, EPSTEIN E. Dynamic contrast-enhanced ultrasound improves diagnostic performance in endometrial cancer staging[J]. Ultrasound Obstet Gynecol, 2020,56(1):96-105.
[5] STOELINGA B, JUFFERMANS L, DOOPER A, et al. Contrast-enhanced ultrasound imaging of uterine disorders: A systematic review[J]. Ultrason Imaging, 2021,43(5):239-252.
[6] XU J, QIAO L, XIONG K, et al. Diagnostic value of quantitative analysis by contrast-enhanced ultrasound of endometrial lesions[J]. J Ultrasound Med, 2021,40(6):1131-1136.
[7] 中国医师协会超声医师分会.中国超声造影临床应用指南[M].北京:人民卫生出版社,2017:178-182.
[8] PECORELLI S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium[J]. Int J Gynaecol Obstet, 2009,105(2):103-104.
[9] LIN M Y, DOBROTWIR A, MCNALLY O, et al. Role of imaging in the routine management of endometrial cancer[J]. Int J Gynaecol Obstet, 2018,143(Suppl 2):109-117.
[10] 刘春英,王晓芳,谢晴,等.超声造影对Ⅰ期子宫内膜癌肌层浸润的诊断价值[J].中国医学影像技术,2011,27(7):1443-1446.
[11] 周克松,李明星.子宫内膜癌超声造影与经阴道彩色多普勒超声表现比较[J].中国超声医学杂志,2015,31(1):50-52.
[12] 王立淑,于腾飞,徐云,等.超声造影在子宫内膜恶性病变诊断中的价值[J].中华超声影像学杂志,2022,31(3):226-230.
[13] 徐嘉,谯朗,汪洋,等.超声造影对子宫内膜病变的诊断价值[J/CD].中华妇幼临床医学杂志(电子版),2018,14(5):535-541.
[14] ZHOU H L, XIANG H, DUAN L, et al. Application of combined two-dimensional and threedimensional transvaginal contrast enhanced ultrasound in the diagnosis of endometrial carcinoma[J]. Biomed Res Int, 2015,2015:292743.
[15] 林冬梅,朱云晓,袁鲲,等.IETA常规超声特征与超声造影对子宫内膜癌病理分期的评估价值[J/CD].中华医学超声杂志(电子版),2022,19(5):405-415.
[16] 高俊飞,谯朗,徐嘉,等.子宫内膜病变超声造影图像特征分析[J].中国超声医学杂志,2019,35(12):1120-1122.
[17] GENG J, TANG J. Contrast-enhanced ultrasound in the diagnosis of endometrial carcinoma: A metaanalysis[J]. Exp Ther Med, 2018,16(6):5310-5314.
[18] PRAISS A M, HUANG Y, St CLAIR C M, et al. A modern assessment of the surgical pathologic spread and nodal dissemination of endometrial cancer[J]. Gynecol Oncol, 2020,157(2):329-334.
[19] CONCIN N, MATIAS-GUIU X, VERGOTE I, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma[J]. Int J Gynecol Cancer, 2021,31(1):12-39.
[20] LIU Z Z, JIANG Y X, DAI Q, et al. Imaging of endometrial carcinoma using contrast-enhanced sonography[J]. J Ultrasound Med, 2011,30(11):1519-1527.
[21] 孙智晶,杨佳欣,沈铿,等.超声造影技术对子宫内膜癌肌层浸润深度诊断价值的探讨[J].生殖医学杂志,2008,17(3):187-191.
[22] LIU Y, XU Y, CHENG W, et al. Quantitative contrast-enhanced ultrasonography for the differential diagnosis of endometrial hyperplasia and endometrial neoplasms[J]. Oncol Lett, 2016,12(5):3763-3770.
[23] SHANG Y, XIE X, LUO Y, et al. Safety findings after intravenous administration of sulfur hexafluoride microbubbles to 463,434 examinations at 24 centers[J]. Eur Radiol, 2023,33(2):988-995.
文献引用
中国医师协会超声医师分会,何文,陈绍琦.子宫内膜癌超声造影中国专家共识[J].中国医学影像技术,2023,39(5):147-151.