骨癌
骨癌在本质上可以是原发性的,例如犬的骨肉瘤(图21),或者骨骼可以被其他癌症浸润(例如猫的口腔鳞状细胞癌)。骨肉瘤是一种侵袭性和侵入性的恶性骨肿瘤,引起溶骨性和增殖性变化,偏好大型和巨型犬(Simpson et al.2017)。这些癌症会导致严重的疼痛,患者通常在疾病的晚期被诊断出来。一项对患有骨肉瘤的犬的研究表明,与健康的犬相比,它们对疼痛的敏感性普遍增加,这意味着它们在身体的任何地方都更疼痛。它们在肿瘤部位有异常性疼痛,在肿瘤周围和其他部位有痛觉过敏,并有抑制性伤害机制的功能障碍。他们的生活质量得分低,活动能力下降,睡眠障碍增加(Monteiro et al. 2018)。
内脏癌
内脏癌(腹部和胸部)会产生疼痛,但可能很难确定疼痛的来源。它可能是由中空器官的扩张和收缩、实体器官或粘膜表面的囊膜的拉伸、由肿瘤侵入或内脏血液供应的压迫引起的局部缺血、或由供应内脏的神经结构或韧带、血管或肠系膜等其他结构的压迫或侵入引起的(Wordliczek & Zajaczkowska,2013)。
1.12营养和疼痛的相互作用
饮食、肥胖和OA疼痛在犬和猫中有着不可分割的联系(Frye et al. 2016, Maniaki et al. 2021)。在犬身上记录了与体重减轻相关的疼痛减轻(Germanet al.2012年)。有关身体和肌肉状况评分的信息,请访问https://wsava.org/global-guidelines/global-nutrition-guidelines/。
对肥胖和骨关节炎疼痛之间密切关系的解释包括由于脂肪组织衍生的促炎介质导致的超重和代谢变化导致的机械负荷增加(Tvarijonaviciute et al. 2012, Van de Velde et al. 2013, Barić Rafaj et al. 2017)。肥胖本身是一种炎症,脂肪是一种活跃的“器官”,可以释放相应数量的细胞因子。
肥胖还会影响肠道微生物群,而肠道微生物群又会影响疼痛和疾病状态(Schott et al. 2018)。肠道微生物与神经系统(神经-内分泌-免疫轴)沟通,并影响疼痛调节(Guo et al. 2019)。慢性疼痛状态以神经炎症为标志,神经炎症导致慢性疼痛,并反过来驱动进一步的神经炎症(Nijs et al. 2020)。饮食也可能通过肠脑相互作用和微生物群的改变导致神经炎症。因此,除了肥胖本身改变痛觉之外,饮食的改变也被认为是调节痛觉的一种方式。然而,改善人类疼痛的饮食干预的细节尚不清楚。一些研究表明,低纤维、高能量饮食通过促炎性中枢免疫信号和胶质细胞激活,与全身氧化应激、细胞坏死和组织损伤有关(Brain et al. 2021)。其他研究表明,高能量密度和高蛋白的生酮饮食有利于缓解疼痛和减少炎症(Field et al. 2021, Ruskin et al. 2021)。一些肠道微生物物种可能产生色氨酸,增加血清素的镇痛作用,而另一些可能产生NMDA受体激动剂,有助于中枢敏化(Nijs et al. 2020)。尽管缺乏利用微生物群控制疼痛的具体数据,但益生元在兽医领域的使用正在扩大,多项研究显示了其对各种胃肠和代谢疾病的益处(Grzeskowiak et al. 2015)。
肥胖、炎症、葡萄糖水平和疼痛之间存在联系(Elma et al. 2020)。一些减少肠道(和全身)炎症的膳食补充剂可能发挥作用,但结果参差不齐(见第2.12章)。营养管理和基于营养的神经炎症的药物阻断剂可能在慢性疼痛的管理中有前途。目前,有证据表明控制肥胖是最有效的疼痛控制方法(Impellizeri et al. 2000, Smith et al. 2006)。
急性疼痛也可能影响食物摄入和进食行为。与牙齿清洁或少量拔牙后的猫相比,多次拔牙后疼痛的猫的干和软食物摄入量明显降低(Watanabe et al. 2019)。此外,在多次拔牙术后长达6天的时间里,猫在进食时“抓取干食物困难”和进食后“摇头”是常见现象(Watanabe et al. 2020b)。
1.13与各种情况相关的疼痛感知水平
将条件指定为类别(表11)仅供参考。疼痛可能因患者、病情及其严重程度而异。每个患者都应该单独评估。同样重要的是要记住,患者的“疼痛史”或“疼痛记忆”会影响当前正在治疗的情况下预期的疼痛——患者的既往或持续疼痛史可能会放大与任何新情况或手术相关的疼痛(即急性或慢性疼痛)。

1.14常见疼痛误解
阿片类药物会导致清醒的犬和猫的呼吸抑制
错误.这种误解是因为人类对阿片类药物的呼吸抑制作用极为敏感。当使用适当剂量时,阿片类药物很少在麻醉期引起严重的不良反应(Wagner et al. 2003)。然而,在患病动物中,阿片类药物应进行滴定以实现镇痛,这将最大限度地降低呼吸系统并发症的风险。建议对患有颅内病变(如头部外伤)的动物和短头品种,尤其是患有短头阻塞性气道综合征的动物进行密切观察和监测(如呼吸频率和深度、脉搏血氧饱和度)。
术中高剂量阿片类药物可能会导致问题
可能是真的.术中阿片类药物是有益的,因为它们减少了麻醉需求并提供了镇痛。麻醉药物的综合作用可能会导致呼吸抑制,但通过人工或机械通气很容易治疗。麻醉恢复期间可能会出现问题;在一项研究中,近25%的在骨科手术中连续输注芬太尼的犬出现麻醉后焦虑(Becker et al. 2013)。
阿片类药物,尤其是高剂量的阿片类药物,在手术过程中作为唯一的镇痛剂时,可能会通过激活神经胶质细胞而加剧疼痛(即阿片类药物诱导的痛觉过敏)。这尚未在兽医学中得到证实,但它可能会导致剂量增加、镇痛不足,并在某些情况下导致痛觉过敏(Colvin et al. 2019)。
非甾体抗炎药(NSAIDs)对犬和猫有毒
错误.炎症是急性和慢性疼痛的常见组成部分,因此NSAIDs是治疗的关键组成部分。NSAIDs被广泛用于缓解全球众多动物的短期和长期疼痛。止痛的好处超过了潜在的风险。必须慎重考虑肝功能受损和晚期肾病动物使用NSAID的利弊。最常报告的犬类不良事件是呕吐、腹泻和厌食(Monteiro-Steagall et al. 2013)。应在给药前对个体患者进行潜在风险因素筛查,并在治疗期间进行监测。许多获准用于人类的NSAIDs在动物中的安全范围很窄,应谨慎使用,或根本不用于动物。如果有针对特定物种的批准药物,应优先使用。
如果我减轻了疼痛,动物会移动,变得更活跃,会破坏缝合线/骨折修复
错误.让动物在手术后经历疼痛来控制运动是不道德的。当需要控制活动时,应采用其他方式(如笼子限制、控制牵引绳行走)。在犬中,曲唑酮的给药促进了术后笼养((Gruen et al. 2014)。受控的负重锻炼对于术后骨折修复至关重要,以确保适当的骨愈合并保持肌肉质量来支撑肢体。不负重会导致骨愈合受损、肌肉萎缩和挛缩。如果不使用止痛剂,运动和物理治疗可能会非常痛苦。如果与腹部或胸部切口相关的疼痛没有减轻,正常的通气可能会受到损害。
幼年患者不会感到疼痛
错误.有强有力的证据支持这样一个前提,即人类新生儿经历疼痛,如果不治疗,实际上可能对疼痛更敏感。这可能导致长期疼痛(Anand 2001)。新生儿的功能MRI研究推断,疼痛的某些特征与成人相似(Ranger&Brunau 2015)。基于哺乳动物之间神经解剖学的相似性,必须假设新生的犬和猫可以感受到疼痛,尽管这可能与成年的感受不同。
止痛药掩盖患者病情恶化的迹象,或阻止适当的诊断或随访
错误.如果患者疼痛,出于伦理原因和减少疼痛相关的不良生理影响,如心动过速、呼吸急促、低潮气量和肠梗阻,体检后应尽快使用止痛药。有些患者在疼痛缓解之前可能无法进行检查。全身注射止痛药(如阿片类药物)可以缓解疼痛,但不太可能完全消除急性创伤或紧急外科手术引起的疼痛(如胃扩张和扭转引起的严重内脏疼痛)。可以使用短效阿片类药物并滴定,以便对患者进行评估,在最小镇静作用下适当缓解疼痛(如神经病学检查)。
麻醉药物是止痛药,因此可以预防疼痛
错误.吸入麻醉剂(如异氟烷、七氟烷)和注射麻醉剂(如丙泊酚、阿法沙龙)等药物会阻碍疼痛感觉,在一些教科书中被称为止痛药。然而,然而,它们不是抗伤害感受性药物和传统的镇痛药。因此,如果出现有害刺激且未使用伤害感受性药物,则在全身麻醉期间仍会发生伤害感受(转导、传递和调节)。醒来后,患者会感到疼痛(一种有意识的情绪,伴有神经内分泌变化)。
疼痛管理只关注药物的使用
错误.治疗急性和慢性疼痛的方法应该是综合的,这意味着结合药物和非药物治疗。非药物疗法的例子包括但不限于针灸、医疗按摩、饮食、营养添加剂或补充剂、物理康复以及护理和支持性护理。冰或冷疗法(第2.10章)是一种有效且廉价的疗法(Wright et al. 2020)。正如使用镇痛药物组合被称为多模式一样,药物和非药物技术的使用也是多模式的,并可能为患者提供额外的益处。
患有关节疼痛的患者禁止进行运动
错误.受控锻炼可减少各种急性疼痛和某些慢性疼痛的疼痛体验(Naugle et al. 2012)。研究表明,运动激活了各种内源性镇痛神经调节系统,如阿片类药物、一氧化氮、血清素、儿茶酚胺和内源性大麻素(Santos & Galdino 2018)。锻炼也有益于软骨结构和功能;肌肉、筋膜、肌腱和韧带的活动性;骨和椎间盘的结构和功能。不活动会加剧各种软组织来源的疼痛感(Langevin et al. 2018)。受控锻炼、等长运动和平衡运动、活动范围和强化锻炼、游泳和在水下跑步机上锻炼都是有益的。
注射了镇静剂的动物不太可能感受到疼痛
错误.镇静只是掩盖了疼痛的行为迹象以及我们识别和评估疼痛的能力。使用非止痛药物进行镇静会使患者看起来很舒服,但是如果对他们进行评估(例如对他们的手术部位进行触诊),他们可能会感到疼痛。镇静可能是可取的,但应通过镇痛药和镇静剂或镇定剂或具有镇静性质的镇痛药(如右美托咪定、布托啡诺)的组合来实现,并且患者必须接受定期疼痛评估。
所有的行动障碍都是疼痛的结果
错误.OA/DJD相关疼痛是犬和猫活动障碍的常见原因。然而,还有其他原因,包括退行性脊髓病、老年性喉麻痹多发性神经疾病、猫的糖尿病神经疾病、前庭疾病继发的共济失调和趾甲过长。视力下降或失明可能会损害动物的探索行为。区分疼痛与其他形式的虚弱或活动能力对于评估生活质量至关重要。
补充剂和草药是天然的,因此使用起来总是安全的
错误.许多护理人员和兽医支持使用草药和补充剂作为疼痛的辅助治疗。重要的是要对这些产品有充分的了解,包括它们的副作用和与药物的相互作用。正如有毒植物教科书所揭示的那样,单纯的自然并不意味着安全。例如,血清素综合征(血清素水平升高引起的一系列临床症状)可能是圣约翰草(贯叶连翘)等补充剂最常见的不良事件。血清素综合征可能是由于用药过量或因为患者已经接受了改变血清素水平的其他药物(如氯丙咪嗪、氟西汀、曲唑酮)(Mohammad-Zadeh et al. 2008, Almgren & Lee 2013)。乳香和大麻素等植物药可以改变肝酶和其他药物的代谢率。
美国麻醉医师协会(2015)建议在麻醉和手术前停用许多草药和补充剂;这包括可能增加出血的大蒜、银杏、人参和维生素E,以及可能延长某些麻醉药物效果的卡瓦和缬草。
第二节
2.1疼痛治疗的一般方法
疼痛是一种复杂的疾病。这是一种不愉快的经历,涉及感官和情感因素,对每个人来说都是独特的。疼痛最好在早期通过一个强有力的方案来控制。疼痛一旦确定,就很难治疗。显然,这并不总是可能的,如果可能,预防应该是止痛计划的重点。在疼痛的治疗中,目标是消除疼痛,或者至少将疼痛减少到最低限度。
术语“超前镇痛”和“预防性镇痛”容易混淆。超前镇痛是指在组织损伤/侵入之前(即术前)给予镇痛药物。预防性镇痛是一种更合适的临床方法,因为它指的是术前、术中和术后给予镇痛剂。它考虑了所有围手术期可能导致外周和中枢敏感化的因素,并涉及任何用于缓解疼痛的围手术期镇痛技术/药物(Dahl & Kehlet 2011)。常用于预防性镇痛的药物包括非甾体抗炎药、局部麻醉剂、阿片类药物、α2-肾上腺素受体激动剂、NMDA拮抗剂(如氯胺酮)和加巴喷丁。冷疗是术后最容易使用的非药物疗法(Wright et al. 2020)。这些疗法降低了围手术期疼痛的严重程度,并可能有助于降低术后持续性疼痛的发病率。
多模式镇痛包括使用药物和非药物疗法(一种综合方法)。作用于伤害感受通路不同部位的药物和治疗的伴随给药提供了最佳的止痛效果。因为它们针对不同的疼痛机制,所以可以施用较低剂量的每种药物,从而将副作用的发生降至最低。用于治疗疼痛的药物的选择将取决于疼痛的潜在原因、其严重程度和持续时间。需要了解每个物种以及不同年龄和身体状况的患者的药物药理学知识。例如,药物的药代动力学特征在成年、幼年(小于12周龄的小犬和小猫)、老年(预期寿命达到75%以上的犬和猫)和伴有并发症的患者中可能不同,这可能会改变给药方案。药代动力学数据不应该从一个物种推断到另一个物种,特别是在犬和猫之间。
在可行的情况下,应在疼痛管理方案中加入非药物治疗。积极的情绪在减轻疼痛方面起着重要的作用。鼓励采取一切措施减少压力、恐惧和焦虑,并提供积极的精神和身体刺激。在围手术期,这些包括在安静的环境中提供温暖、干净和舒适的寝具,温柔地抚摸动物并积极地与动物互动,为猫提供隐藏空间和升高的表面,如果可能的话带犬经常散步等。在慢性疼痛中,这些包括通过刺激玩耍行为来增加身体活动,促进积极的互动来加强人与宠物的联系,以及提供丰富的环境。
急性疼痛
急性疼痛是由创伤、手术或感染事件引起的。围手术期疼痛是急性疼痛的典型例子。它可分为四个关键时间点:术前;术中;术后立即(“住院”);和术后后期(“在家”、“愈合期”)。镇痛计划影响术后疼痛的程度。围手术期疼痛管理应结合应用预防性和多模式镇痛概念的几种不同类别的药物。疼痛缓解也可以通过非药物疗法来提供,包括冷疗、针灸、被动活动范围锻炼、按摩、治疗性锻炼、水疗、超声波和电刺激(Tick et al. 2018)。护理包括仔细考虑物理环境、伤口护理、膀胱排空和人与动物的互动,这对改善住院体验非常重要(第2.13章)。
围手术期疼痛的程度会受到手术技术(Xu & Brennan 2010)和位置的影响。应尽可能采用温和的组织处理和尽量减少创伤的技术(例如小切口;微创手术,如关节镜和腹腔镜)(Culp et al. 2009)。当手术前出现炎症或慢性疼痛时(如脓腔、癌症或骨关节炎),手术期间和手术后的疼痛程度可能更大,需要在更长的时间内更频繁或更高剂量的镇痛药。这通常被描述为“急性的慢性”疼痛。疼痛量表可用于优化止痛方案。
慢性疼痛
慢性或适应不良疼痛可能与原发疾病有关,也可能单独存在。在人类中,慢性疼痛通常伴有恐惧、焦虑、抑郁和愤怒,这会加剧疼痛及其对患者生活质量的负面影响。虽然它可以影响任何年龄的患者,但老年动物更容易受到影响。与慢性疼痛相关的行为改变起病隐匿,不易察觉,经常被诊断不足或误认为“只是变老了”(Monteiro & Steagall 2019b)。治疗患有慢性疾病(如长期中耳炎、慢性伤口、炎症性肠病OA)的动物的兽医应始终考虑伴随慢性疼痛的可能性。治疗方法取决于疼痛的根本原因、持续时间以及之前的处理情况。慢性疼痛可能表现为先前控制良好的疼痛的急性恶化(“慢性疼痛上的急性”)。多模式的方法可能是最有效的,护理教育是必不可少的,特别是在治疗预期和预后方面。治疗慢性疼痛的主要药物是非甾体抗炎药;然而,单克隆抗体等其他疗法的证据越来越多。还应考虑辅助疗法,并应更加关注可能降低普遍致敏性的疗法。
在慢性疼痛中,宠物护理人员高度参与,并作为卫生保健团队的一部分。例如,他们在家庭环境中观察动物,完成护理人员评估的CMIs,并录制视频与兽医团队分享。他们还负责监测治疗效果、服用止痛药并改变动物的环境(即环境改变;图22)和生活方式(如体重控制和身体活动)。

图22.改变环境的策略。(A)自制工具刺激猫咪身心的例子。礼品包装、购物袋和随机包装盒上的胶带都可以使用,网上也有很多创意。请注意,不应使用细绳和螺纹,因为存在意外摄入线性异物的风险。在这张图片中,一个鞋盒和卫生纸卷筒被用来创建一个“喂食谜题”干粗粮分布在卫生纸卷筒上,猫需要寻找和够到食物。或者,食物可以放在蛋盒里。增加食物消耗时间的策略有助于饱腹感和体重控制。(B)市场上可买到的猫公寓、隧道、抓挠柱、食物拼图和转轮的例子。图(A)由Beatriz Monteiro提供。图(B)转载自Monteiro(2020)
2.2阿片类药物
它们是什么
阿片是一种从开花的罂粟植物中天然提取的药物。阿片类是一个更广泛的术语,包括阿片类药物,是指与阿片受体结合的任何天然或合成物质。多年来,阿片类药物一直是兽医急性疼痛管理的基石。它们的受体特异性、效力和疗效各不相同,导致不同的临床效果。阿片类药物通常分为四组:完全激动剂[吗啡、美沙酮、芬太尼及其衍生物、哌替啶(度冷丁)等]、激动剂-拮抗剂(布托啡醇和纳布啡)、部分激动剂(丁丙诺啡)和拮抗剂(纳洛酮、纳美芬和纳曲酮)。后一组缺乏激动剂活性。阿片类药物具有很高的疗效,在动物中非常安全,部分原因是其可逆性(Simon&Steagall 2017)。大多数阿片类药物是受管制的物质,在一些国家,兽医无法获得。根据WSAVA《猫和犬基本药物清单》(Steagall et al. 2020a),它们被视为核心基本药物。由于药代动力学-药效学效应、性别、年龄、基因型、阿片受体的类型和数量及其在中枢神经系统内的分布和脑转运机制的差异,阿片类药物给药后的个体反应可能存在差异。例如,曲马多的代谢物(O-去甲基-曲马多;M1代谢物)具有阿片活性,但将曲马多代谢为该代谢物的能力是物种特异性的。与猫和人不同,在犬中施用曲马多不会导致该代谢物的血浆浓度显著升高(Perez Jimenez et al. 2016)(见第2.7章)。
它们是如何工作的
阿片类药物与中枢和外周神经系统中的阿片受体[μ (mu), κ (kappa), δ (delta),伤害性肽及其亚型]结合,抑制脊髓传入神经纤维释放兴奋性神经递质,从而抑制伤害性刺激的突触传递。突触后,增强的钾(K+)流出导致脊髓投射神经元的超极化,并抑制上行伤害性通路。阿片类药物不会干扰运动功能或本体感觉(Simon & Steagall 2017)。
适应症
阿片类药物会产生镇痛、欣快、散瞳(猫)或缩瞳(犬)、镇静或兴奋(烦躁)以及其他几种生理效应,具体取决于物种。它们用于治疗中度至重度疼痛。它们的镇痛作用取决于阿片类药物、剂量、给药途径、给药系统和给药物种(Hofmeister & Egger 2004)。
阿片类药物被广泛用于围手术期,作为多模式和预防性镇痛的一部分,并具有麻醉节省作用(即减少对吸入麻醉药的需求)(表12)。它们也广泛用于急诊和重症监护环境(即胰腺炎、烧伤、创伤、脑膜炎)。在临床上,硬膜外注射吗啡用于术后镇痛。如果使用适当的剂量和给药间隔,阿片类药物很少引起猫兴奋(“吗啡-躁狂”)。镇静作用通常发生在犬身上,最常见于老年、幼年和重症病患。优选静脉内(iv)和肌肉内(im)给药(Steagall et al. 2006);然而,丁丙诺啡和美沙酮可以通过口腔粘膜途径给药,以在猫中产生抗伤害感受。口服阿片类药物在犬猫体内的生物利用度极低,不应用于镇痛。

研究表明,小猫和成年猫对阿片类药物的反应可能不同。与6个月大的猫相比,12个月大的猫的抗伤害感受的强度始终较大。在该研究中,与9个月和12个月相比,氢吗啡酮在相同的猫中在6个月时提供了更短的持续时间和更小的抗伤害感受。这些结果表明,6个月大的小猫可能需要比成年猫更频繁地服用阿片类药物(Simon et al. 2019)。
不良反应
副作用可能包括恶心和呕吐、烦躁、气喘(犬)、心动过缓、组胺释放(吗啡和哌替啶(度冷丁),尤其是通过快速静脉注射给药时)、尿失禁/尿潴留(施用硬膜外吗啡后)和呼吸抑制。然而,副作用通常与高剂量有关。较不常见的是,可以观察到食欲不振、坐立不安、便秘和体温过低或体温过高(最常见于猫使用氢吗啡酮后)。通过仔细滴定纳洛酮或布托啡诺可以逆转这些副作用(表12)。然而,镇痛也可能被逆转。
禁忌症
兽医必须权衡阿片类药物给药的利弊,因为当疼痛管理是优先事项时,一些不想要的或不良的影响可能与临床无关。
药物相互作用
阿片类药物通常与苯二氮卓类药物、α 2肾上腺素能受体激动剂或乙酰丙嗪(神经轻镇痛药)联合用药。阿片类药物在与非甾体抗炎药(Steagall et al. 2009)和局部麻醉联合使用时可能具有协同作用(作为多模式镇痛的一部分)。混合使用不同组的阿片类药物(即布托啡诺和丁丙诺啡、布托啡诺和氢吗啡酮)会产生不可预测的效果,不建议使用。
特殊注意事项
阿片类药物耐受性在人类和实验动物中有报道,但在兽医中短期使用很少出现问题。有报道称,阿片类药物诱导的人类和大鼠痛觉过敏;然而,这还没有在小动物临床中得到记录。
无阿片类或少阿片类麻醉
不幸的是,国际兽医界并不总是能够获得阿片类镇痛剂,导致不必要的动物痛苦和兽医人员的同情疲劳。阿片类药物的替代品包括使用多模式镇痛的技术,包括局部麻醉剂、非甾体抗炎药和其他辅助镇痛药。它们通常被称为少用阿片或不用阿片的麻醉。在接受卵巢子宫切除术的猫中,研究了包括氯胺酮(5 mg/kg)、咪达唑仑(0.25mg/kg)和右美托咪定(40μg/kg)的无阿片类药物注射方案(im)的麻醉和镇痛作用。手术后也给猫腹膜内注射布比卡因(2 mg/kg)和美洛昔康(0.2 mg/kg)。该协议为手术提供了足够的麻醉;然而,大多数猫的术后镇痛效果并不理想,与小猫相比,成年猫的抢救镇痛率更高(Diep et al. 2020)。在成年猫中进行的类似设计的后续研究比较了无阿片样物质和阿片样物质保留方案(即,术前施用丁丙诺啡)。研究表明,单剂量丁丙诺啡消除了术后救援镇痛的需要(在阿片类药物保留组和无阿片类药物组中,分别有0/14和5/14的猫需要救援镇痛)(Rufiange et al. 2022)。另一项随后在小猫中进行的研究比较了类似的无阿片类药物方案与多模式镇痛或无多模式镇痛。多模式组术前给予美洛昔康,术中给予布比卡因腹腔注射。对照组(n=15/15)的抢救镇痛发生率高于多模式组(n=1/14) (Malo et al. 2022)。建议将关于阿片类药物在犬猫中的使用的综述(包括临床指南,以及与阿片类药物镇痛相关的误解和争议)作为补充阅读材料(Steagall et al. 2014, Bortolami & Love 2015, Simon & Steagall 2017, Kongara 2018)。
2.3非甾体抗炎药(NSAIDs)
它们是什么
非甾体抗炎药具有解热、抗炎和镇痛作用(表13)。尽管存在一些注射制剂,但它们通常口服给药。非甾体抗炎药主要在肝脏代谢,通过胆汁(粪便)和尿液排出。

它们是如何工作的
NSAID在花生四烯酸级联中发挥作用。它们或者阻断环氧化酶(COX)的活性以及随之而来的前列腺素的产生,或者,如piprants的情况(见下文),阻断前列腺素与其受体的相互作用(图23)。COX-1产生一系列参与生理过程的前列腺素,包括血管稳态、胃保护、肾血流和血液凝固。COX-2还与一些生理功能相关,但它主要在组织损伤后释放,产生炎性前列腺素(Monteiro & Steagall 2019a)。通过抑制COX活性,NSAIDs提供了镇痛作用(抑制炎症和疼痛),但也可能导致副作用(抑制生理功能)。单个NSAIDs不同程度地抑制COX-1和COX-2。
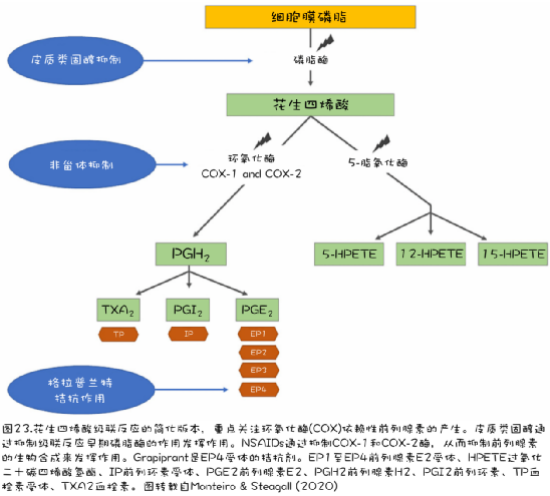
适应症
COX-抑制性NSAID是围手术期以及其他急性和慢性疼痛状态(如OA、癌症和其他炎症状态)的有效镇痛剂(表13)。根据疼痛的严重程度,它们可以作为唯一的止痛剂或与辅助药物联合使用(Monteiro & Steagall 2019a)。当用于慢性疼痛疾病(如OA)时,它们通常被滴定至最低有效剂量,但这应与仔细的患者再评估相结合(Wernham et al. 2011)。临床疗效可能因人而异;当患者的反应不令人满意时,可能需要更换NSAID,并有一个适当的清除期(见第1.14章)。
禁忌症
NSAID相关的不良反应通常与胃肠道有关(厌食、呕吐、腹泻、食欲下降)。其他不常见的副作用包括血小板聚集减少以及肾和肝毒性。胃肠影响通常是自限性的,尽管不适当的给药会导致溃疡和穿孔(Lascelles et al. 2005)。据报道,使用用非甾体抗炎药后,非临床相关的血小板聚集减少(Lemke et al. 2002)。这在健康的动物中不应该是一个问题;然而,使用COX-1选择性药物或阿司匹林时应谨慎。阿司匹林可以在血小板的整个寿命期间抑制环氧化酶;因此,应避免在手术前使用,仅在手术结束时止血得到确认时使用。肝毒性很少报道,在大多数情况下被认为是一种特殊反应(MacPhail et al. 1998)。建议长期使用时,根据具体情况通过远程医疗或体检血液化学分析进行定期监测。患有未控制的胃肠疾病、肝病、凝血障碍、低血容量、脱水或低血压的患者禁用NSAIDs。患有伴随慢性疼痛和稳定慢性肾病[国际肾脏协会(IRIS)I至III期]的猫科动物患者可以使用美洛昔康或罗贝考昔进行治疗,前提是对其进行密切监测(Monteiro et al. 2019)。总体而言,NSAID似乎与较低的不良反应发生率相关,大多数临床研究未能显示与安慰剂相比的不良反应差异(Monteiro-Steagall et al. 2013);然而,大多数研究没有被适当地设计来检测安慰剂和治疗犬之间在副作用方面的显著差异。当副作用发生时,对个别病患来说可能是灾难性的,因此必须提供替代的止痛方法。在轻度病例中,建议临床医生立即停止使用NSAID,并提供支持性治疗,包括液体疗法和胃保护剂。严重的病例可能需要外科手术和重症监护(Lascelles et al. 2005)。应将不良反应报告给制药公司或地区监管机构(如美国的美国食品药品监督管理局兽医中心或英国的兽医药品管理局)。
药物相互作用
NSAID不应与皮质类固醇或其他NSAID(包括阿司匹林)同时使用或暂时联合使用。与血管紧张素转换酶抑制剂、利尿剂、华法林、苯巴比妥钠或化疗药物合用时应谨慎。
从一种NSAID转换到另一种NSAID
不同NSAID给药的动物在副作用耐受性和临床反应方面可能存在差异。出于这两个原因(缺乏镇痛反应或不良反应),在NSAID之间切换,或在COX抑制和非COX抑制NSAID间切换是合适的。当考虑因缺乏疗效而从一种NSAID切换到另一种时,应考虑洗脱期(即患者未接受NSAID)。尽管最保守的方法是使用几天的洗脱期,但没有科学证据表明这是必需的,也没有任何科学证据表明什么样的时间是合适的。如果由于胃肠道不良反应而考虑在NSAID之间切换,那么快速切换到抑制COX-2的药物可能会延迟愈合并恶化病变。在这种情况下,可能需要7天的洗脱期。在犬而不是猫,扑热息痛(对乙酰氨基酚)可以在洗脱期间使用。不建议在围手术期切换NSAID(即,如果患者已经在使用NSAID,则继续使用同一种NSAID)。最后,根据作者的经验,在grapiprant和NSAID之间切换时不需要洗脱,尽管没有研究评估这种做法的安全性。
其他抗炎药
Grapiprant(拉普兰特)被认为是一种NSAID——一种非COX抑制性NSAID。Grapiprant属于piprant类药物(PGE2受体拮抗剂),其进一步作用于花生四烯酸级联,阻断PGE2与其受体的相互作用(图23)。具体来说,grapiprant是一种EP4受体拮抗剂,在一些国家被批准用于治疗与犬OA相关的疼痛和炎症。在一项涉及OA犬的随机安慰剂对照临床试验中,该药物被证明是安全有效的(Rausch-Derra et al. 2016)。
扑热息痛(对乙酰氨基酚)是一种NSAID,被认为作用于中枢神经系统中存在的COX-1的亚型。它具有镇痛和解热作用,但几乎没有抗炎活性(Pacheco et al. 2020)。在围手术期,在接受软组织或骨科手术的犬中,发现口服和静脉注射扑热息痛均不劣于许可的NSAID(Hernández-Avalos et al. 2020)。有争议的是,卵巢子宫切除术后静脉注射扑热息痛或生理盐水对犬的术后疼痛评分没有影响(Leung et al. 2021)。据传闻,扑热息痛单独或与可待因联合用于治疗犬的慢性疼痛,作为多模式方法的一部分;然而,几乎没有证据支持其用于犬的急性或慢性疼痛管理(Buds- berg et al. 2020)。对于猫,扑热息痛(对乙酰氨基酚)是严格禁止的,因为它会增加患高铁血红蛋白血症的风险。
安乃近也是一种具有镇痛、解热和解痉特性的弱抗炎药物,主要通过抑制中枢神经系统中的COX-1亚型产生。安乃近已在多个国家获准用于犬的围手术期,并可与NSAIDs联合使用(Zanuzzo et al. 2015)。有一些证据表明其对犬和猫有效(Imagawa et al. 2011, Teixeira et al. 2020, Pereira et al. 2021)。在接受卵巢子宫切除术的猫中,安乃近(25 mg/ kg q24或12.5 mg/kg q12h)提供了与美洛昔康(0.1mg/kg q24h)相似的镇痛效果(Pereira et al. 2021)。
2.4 α2肾上腺素受体激动剂
它们是什么
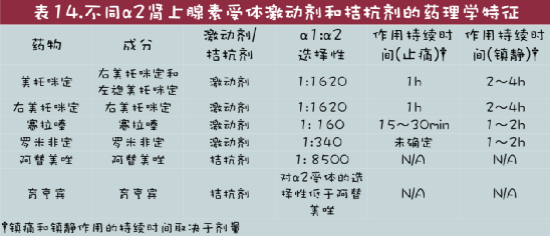
α2肾上腺素受体激动剂是产生镇静和催眠、镇痛和肌肉松弛的药物(表14)。这类药物的受体特异性和效力各不相同。当给予拮抗剂(阿替美唑或育亨宾)时,α2-肾上腺素受体激动剂具有可逆性的益处;但是,镇痛作用也会逆转。镇静效果从30到90分钟不等,取决于药物、给药途径和所用剂量。这些药物通过肝脏代谢并由肾脏排泄(Murrell & Hellebrekers 2005)。
它们是如何工作的
这些药物与脊髓背角(脊髓镇痛)、大脑皮层和蓝斑(镇静和脊髓上镇痛)中不同的α2-肾上腺素受体亚型受体结合。去甲肾上腺素(正肾上腺素)是这些受体的内源性配体,存在于去甲肾上腺素能和非去甲肾上腺素能神经元上。这些药物通过引起膜超极化的复杂机制抑制兴奋性神经递质的释放,其方式类似于阿片类镇痛药。α2-肾上腺素受体激动剂也与血管内皮中的受体结合,引起外周血管收缩,增加全身和肺血管阻力,同时以剂量依赖性方式降低心输出量。
适应症
α2-肾上腺素受体激动剂被广泛用于非侵入性程序的镇静,并作为神经安定药痛觉过敏和平衡麻醉方案的一部分。它们被认为是多种临床环境中的镇痛佐剂,因为它们可以在减少应激反应的同时补充镇痛。在麻醉恢复期间,尤其是出现谵妄和烦躁不安时,可给予小剂量(1至2 μg/kg静脉注射右美托咪定)。它们的使用通常保留给能够耐受显著血液动力学变化的健康动物和/或野生和不合群的动物(Pypendop & Verstegen 1998)。
同时使用α2肾上腺素受体激动剂和阿片类药物可能会改善镇痛效果,因为它们具有协同作用,从而降低阿片类药物的需求(Pascoe et al. 2006)。
持续速率输注
通过持续速率输注(CRI)施用右美托咪定或美托咪啶在犬和猫的围手术期提供镇静或持续镇痛正变得流行。通过CRI使用药物克服了由单剂量右美托咪定或米托咪啶提供的相对短的镇痛持续时间的限制。在手术中使用CRI允许吸入麻醉剂的显著最小肺泡浓度(MAC)节省效果,同时提供非常稳定的麻醉深度平面。术后,产生镇静作用,但动物可能对外界刺激有反应。当需要对患者进行频繁的重新评估时,或者在患者散步和如厕时,这可能是有用的。然而,当意想不到的突然唤醒发生时(例如,大声的噪音或有害的刺激),这可能会产生问题,导致定向障碍,导致防御性行为(例如,咬)。已调查的剂量通常为右美托咪定是1至2ug/kg的负荷剂量,然后是1ug/kg/h(Lin et al. 2008, Valtolina et al. 2009)。
右美托咪定口腔粘膜凝胶
配制在口腔粘膜凝胶(0.1mg/ml)中的右美托咪定已上市,用于控制犬的噪音厌恶,并在面颊和牙龈之间给药。右美托咪定的建议剂量太低,不足以引起镇静,但已被证明可以减少焦虑,这可能是通过减少蓝斑的活性来实现的,蓝斑是警惕性、交感神经紧张度和注意力的重要调节剂(Korpivaara et al. 2017)。右美托咪定口腔粘膜凝胶在其他情况下,如之前或在兽医就诊期间,是否有减轻焦虑的作用,目前尚未研究。
地托咪定口腔粘膜凝胶
以凝胶(7.6 mg/mL)配制的地托咪定适用于马的镇静和化学抑制,并将其置于舌头下方。在犬中,研究了将0.35至2.0 mg/m2剂量的地托咪定凝胶放置在颊袋中,以促进处理并在健康犬中进行短时间的微创手术(Hopfensperger et al. 2013, Messenger et al. 2016, Kasten et al. 2018)。达到峰值镇静的时间约为45分钟,持续时间约为30分钟;心肺作用类似于其他α2肾上腺素受体激动剂诱导的心肺作用,这两种效应和镇静作用都可以使用阿替美唑逆转((Hopfensperger et al. 2013, Kasten et al. 2018)。在健康猫中,4 mg/m2的剂量提供了不同的镇静作用,并且在每种情况下都会出现呕吐,这表明这在该物种中是一种不太理想的技术(Smith et al. 2020)。
不良反应
最常见的副作用包括高血压和/或低血压、心动过缓、体温过低、交感神经张力和胃肠动力下降、尿量增加、暂时性低胰岛素血症和高血糖。可能会观察到其他不太常见的副作用,如呕吐、流涎和缓慢性心律失常(Granholm et al. 2006, 2007)。
预防措施
患有心肺疾病(伴有或不伴有心律失常或传导障碍)、严重全身性疾病、既往低血压/高血压、糖尿病和肝/肾功能衰竭的动物慎用。患有肥厚型心肌病和左心室流出道梗阻(LVOT)的猫可能是一个例外:美托咪定已被证明可减少LVOT和降低心率,改善心室充盈(Lamont et al. 2002)。在外伤患者中使用时应谨慎。除非同时存在心动过缓和低血压,否则禁止将抗胆碱能药与α2-肾上腺素受体激动剂联合使用。
外周作用的α2-肾上腺素受体拮抗剂(Vatinoxan/ MK-467)
Vatinoxan是一种外周作用的α2-肾上腺素受体拮抗剂,与α2-肾上腺素受体激动剂联合使用。它防止外周介导的血管收缩,因此减少了α2-肾上腺素受体激动剂后出现的反射性心动过缓(Kallio-Kujala et al. 2018),并已被证明与单独施用α2-肾上腺素受体激动剂相比,可改善犬的心输出量(Honkavaara et al. 2011)。已发表的研究调查了α2-肾上腺素受体激动剂与Vatinoxan联合用药对犬和猫的镇静、止痛、神经内分泌和心血管作用。Vatinoxan的镇静和止痛作用基本不变,而心血管和神经内分泌作用减弱。2022年3月,美国美国食品药品监督管理局批准了美托咪啶和Vatinoxan注射液的组合在小型手术中用作犬的镇静剂和镇痛剂。
特殊注意事项
一些动物似乎不受α2-肾上腺素受体激动剂药物的影响,并且在给药后不能很好地镇静。这通常与预先存在的高度兴奋状态有关。
2.5局部麻醉剂
它们是什么以及如何工作
局部麻醉剂通过阻断电压门控钠离子通道的主要内向钠离子电流来抑制膜去极化、神经兴奋和传导。这些药物价格低廉,没有管制,在世界范围内容易获得,是WSAVA猫和犬基本药物清单中的核心药物(Steagall et al. 2020a)。因此,局部麻醉剂有可能广泛应用于猫和犬的疼痛控制。
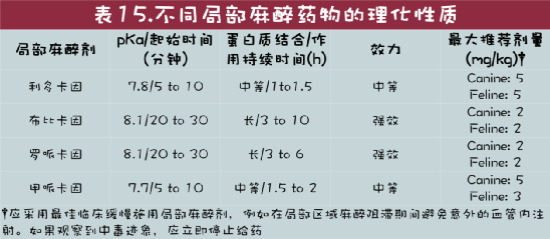
在小动物中最广泛使用的局部麻醉药物是利多卡因、甲哌卡因、布比卡因和罗哌卡因。所有这些试剂都被归类为氨基酰胺。局部麻醉剂是弱碱,因此根据它们的pKa在体内保持平衡。药物的pKa是50%的药物为电离形式和50%的药物为非电离形式时的pH值。这对于局部麻醉剂是重要的,因为药物的非电离形式可以穿过神经元细胞膜进入电压门控Na+通道,而药物的电离形式结合Na+通道受体以阻断Na+离子进入神经元。因此,具有更接近生理pH值的低pKa的局部麻醉剂(例如利多卡因)将具有更快的起效,因为更大比例的药物在生理pH值下将是非电离的。决定局部麻醉剂特性的其它物理化学特性是分子量、脂溶性和蛋白质结合(方框4,表15)。

局部麻醉剂的全身毒性
局部麻醉剂的全身毒性最有可能通过意外过量而发生,因此更有可能发生在较小的患者中,例如猫和小犬。
影响全身毒性的因素包括
l注射部位:血管注射部位导致药物更快地吸收到体循环中,因此药物的血浆浓度更高,具有更大的毒性风险。不经意的静脉或动脉注射也是毒性的一个重要风险因素,特别是对于布比卡因。
l所用药物:例如,布比卡因因其与心脏中的电压门控Na+通道受体缓慢分离而具有特别的心脏毒性。
局部麻醉剂的心血管效应
由于心肌传导减慢、心肌抑制和外周血管舒张的综合作用,当局部麻醉剂的全身浓度达到毒性水平时,会发生低血压、心动过缓和心脏骤停。
局部麻醉剂的中枢神经系统效应
局部麻醉剂是脂溶性的,分子量低,因此容易穿过血脑屏障。在较高浓度下,它们引起惊厥,随后出现全身性中枢神经系统抑制。
局部麻醉毒性管理
局部麻醉药物毒性的治疗集中在支持性护理和不良事件(如癫痫发作)的针对性治疗上。苯二氮卓类药物可用于控制癫痫发作,如果需要,可配合氧疗、气管插管和通气。可能需要液体支持和正性肌力药物来控制心脏毒性。脂质溶液可以通过在血浆中形成一个脂质隔室,吸引亲脂性化合物(如局部麻醉剂),从而将它们从血浆的水相中分离出来,从而直接对抗局部麻醉剂毒性(Weinberg et al. 2003, O’Brien et al. 2010, Muller et al. 2015)。
小动物局部麻醉/镇痛技术
作为小动物麻醉和止痛疗法的一部分,局部麻醉技术仍然经常被忽视。然而,使用局部技术通常可以减少维持麻醉所需的其他麻醉药物的剂量,并有助于多模式止痛技术。使用特定的神经阻滞来防止伤害性信息从损伤部位传递到脊髓,也可以提供超前镇痛,并防止或减少中枢敏感化的发展。
局部麻醉(经粘膜).将一些局部麻醉药物应用于粘膜可迅速产生镇痛作用(5分钟内)。局部给药的位置包括用于眼部检查的角膜、鼻腔通道(例如,在插管期间放置鼻氧气套管和喉之前)。在组织中产生的止痛深度通常很小(1至2 mm)。局部麻醉剂通过皮肤(角质层)的吸收通常很差。如果将利多卡因和丙胺卡因的低共熔混合物应用于皮肤并用非渗透性敷料覆盖30至40分钟,则可以产生麻醉。这有助于在猫和犬的静脉导管放置或静脉穿刺之前提供局部镇痛。
渗透麻醉.局部麻醉剂的渗透通常在兽医手术中进行;它安全可靠,不需要丰富的经验。应该使用无菌针头。例如,局部麻醉剂可以沿着腹部和半椎板切除术切口渗透(即切口麻醉)。该技术可以在手术之前和/或之后应用。当进行半椎板切除术时,术前切口周围浸润比伤口闭合时浸润获益更多(McFadzean et al. 2021)。
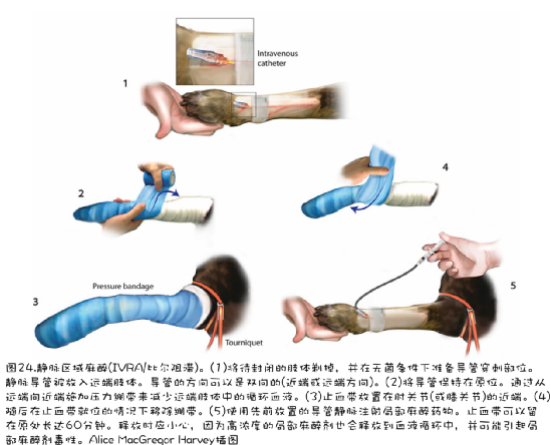
区域麻醉.使用神经刺激器或超声波来定位外周神经可以显著提高药物沉积的准确性,从而提高阻滞的有效性。它还可以允许使用较低总体积的局部麻醉药物,减少由于局部麻醉剂吸收到全身循环中而引起的运动副作用和毒性风险(例如臂丛神经阻滞导致肘部远端感觉和运动功能的丧失)。区域麻醉示例见图24。
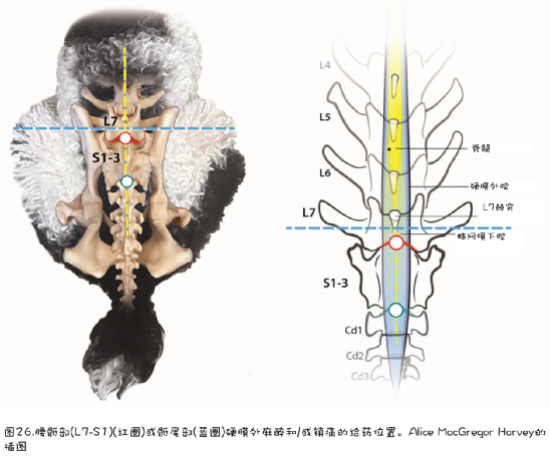
硬膜外麻醉.腰骶部硬膜外麻醉可用于膈肌尾部所有手术的镇痛(图25和26)。它对后躯的骨科手术特别有用。骶尾部硬膜外麻醉可用于尾部泌尿生殖外科手术(图26)。
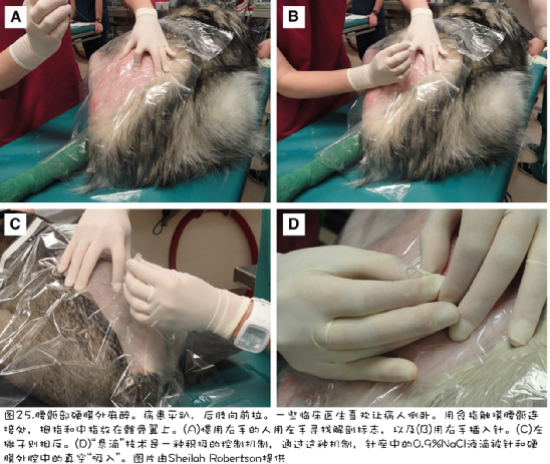
牙齿神经阻滞.上颌和下颌神经阻滞在为牙科手术或下颌或上颌手术提供止痛方面非常有用。当上颌神经和下颌神经分别从眶下孔和颏孔穿出时,它们可以被阻断,或者它们可以在更近侧被阻断以提供更宽的镇痛区域。
局部麻醉剂的腹膜内处理.WSAVA-GPC建议腹膜内和切口麻醉用于疼痛管理,特别是作为接受腹部手术的犬和猫的辅助技术(Steagall et al. 2020b)。在下面的链接中可以看到这两种技术(https://www.youtube.com/watch?v=76dwKuirqt0)。
局部麻醉剂的静脉注射
利多卡因可以通过CRI全身给药,以提供镇痛并降低维持麻醉所需的吸入剂浓度(MAC节省效应)。系统地说,镇痛机制被认为是多种多样的。全身给药后利多卡因的血浆浓度太低,不能直接阻断钠通道。因此,阻断细胞因子产生和抑制NMDA受体的机制被认为是更重要的。接受腹部手术的人的数据相当令人信服,即围手术期利多卡因提供了镇痛作用,并减少了术后阿片类药物的消耗。然而,其他类型手术的数据不太确定(Sun et al. 2012)。
许多研究调查了围手术期利多卡因CRI对接受手术的犬的抗伤害作用。一些研究显示利多卡因CRI对减少手术期间的伤害性反应(血压和心率的变化)和术后疼痛有积极的益处,而其他研究则显示没有益处(Tsai et al. 2013, Gutierrez-Blanco et al. 2015)。已研究的剂量率为2 mg/kg负荷剂量,随后为50μg/kg/分钟的CRI,尽管不同研究之间在负荷剂量和CRI率方面的剂量率有所不同。有更有说服力的证据表明利多卡因CRI对犬的MAC节省作用,这可能对手术期间低血压和需要高浓度吸入剂来维持麻醉的动物有利(Wilson et al. 2008, Moran-Muñoz et al. 2014)。当对接受利多卡因CRI的动物进行麻醉时,应记住这种效应,吸入剂的浓度应根据患者的需要小心调整。由于潜在的心血管副作用,利多卡因CRIs用于猫的镇痛是有争议的。一项实验研究表明,利多卡因CRI对猫的异氟烷也有显著的MAC节省效应,但观察到负面的血液动力学效应(Pypendop & Ilkiw 2005)。出于这个原因,利多卡因输注应谨慎用于猫,因为有血液动力学抑制的风险。然而,在某些情况下,利多卡因可能有助于猫在严重伤害性刺激和高动力状态(高血压和高心率)下的多模式镇痛。
缓释局部麻醉剂(布比卡因脂质体注射混悬液)将在第2.6章讨论。
2.6镇痛剂输送技术和工具
药物的给药方法会对其安全性和有效性产生重大影响。药物输送系统用于在疼痛管理中最小化毒性并提高镇痛药的功效。持续释放或延长释放剂型被设计成在特定时期(即数小时或数天)缓慢释放药物。这种系统可以提供"免手动"镇痛,最大限度地减少全身副作用和药物累积,减少血浆浓度的波动,并避免对输注设备的需求(Krugner-Higby et al. 2011)。
透皮贴剂
透皮贴剂(TD)(芬太尼、利多卡因和丁丙诺啡)是人类批准的粘合贴片,旨在使用储库或基质贴片通过皮肤随时间释放受控剂量的药物(Hofmeister & Egger 2004, Mur- rell et al. 2007, Weil et al. 2007)。这些储库贴片已被用于小动物的疼痛控制,结果不一,因为吸收依赖于皮肤厚度、温度、血管分布等因素,并且粘合剂经常不能保持与皮肤的持续接触。TD药物的使用并不排除使用局部麻醉剂和其他镇痛技术的必要性。
在猫中,芬太尼贴剂的镇痛效果因其吸收和药代动力学的个体差异而高度可变(Egger et al. 2003)。在接受骨科手术的犬中,芬太尼TD在与NSAID一起给药时提供了足够的术后镇痛(Hofmeister & Egger 2004)。芬太尼贴剂起效时间长,必须在需要镇痛前12小时(猫)至24小时(犬)到位。基于基质的芬太尼贴剂不容易被转移,因为药物被整合到贴剂中。
在猫中,尽管可检测到药物的血浆浓度,但经皮基质丁丙诺啡贴剂不会增加热阈值(Murrell et al. 2007)。使用丁丙诺啡贴片的犬的热阈值确实增加了(Pieper et al. 2011)。需要进一步的试验来确定在犬和猫中的临床应用。
缓释制剂
美国批准了一种缓释布比卡因脂质体注射混悬液,用作周围神经阻滞。在接受远端肢体手术的猫中单次神经周给药后,以及在接受前十字韧带手术的犬中渗透后,它可提供长达72小时的局部术后疼痛控制(Lascelles et al. 2016, Gordon-Evans et al. 2020, Reader et al. 2020)。布比卡因脂质体的商业配方尚未在5个月以下的猫或其他局部技术中进行研究。这项技术的一个优点是“保证”了长达3天的镇痛依从性,因为它是由外科医生放置的,不依赖于护理人员给他们的犬或猫喂药。
静脉输液
恒速输注包括通过电子输送装置连续给药设定的剂量方案,以维持恒定的血浆水平。可变速率输注更合适,因为可以根据止痛需要和不良反应的发生来滴定剂量。目标控制输注基于复杂的算法,其中输注速率由输送装置控制,以获得特定的血浆(作用部位)浓度,从而产生期望的效果。
输注装置通常是具有不同输送系统(蠕动式、活塞式、往复式)的容积式输注泵。它们可以以低精度(±10%)提供高容量。注射泵适用于以更高的准确度(±5%)施用更浓缩的止痛药制剂。计算器功能允许用户输入体重、药物浓度和输液速率(Amore&Adam-son 2003)。然而,当输入不正确的浓度或剂量方案时,这些药物输送工具仍然可能出错。
伤口输注导管
伤口输注导管是植入手术部位附近或内部的柔性留置导管,用于为术后疼痛管理提供局部麻醉剂的间歇输注(Abelson et al. 2009)。连续输注与不均匀分布有关(Hansen et al. 2013),该技术最好作为多模式镇痛方法的一部分。
硬膜外导管
硬膜外导管可用于重复硬膜外药物输送。导管插入术是通过使用商用套件(19、20和24号规格)来完成的。这些导管通常通过腰骶椎间隙插入,并允许在长时间的术后间歇或连续给药镇痛药物。导管移位或缠绕以及污染是该技术最常见的并发症(Valverde 2008)。
神经定位器
电神经定位器是用于定位神经的方便、安全且负担得起的设备。它们的临床应用有助于针的放置,并可能缩短起效时间,延长作用持续时间,并降低神经损伤的风险。它们由连接到绝缘针的恒流发生器(低频和持续时间)和附着在皮肤上的远程电极组成。针朝着目标神经前进,并在神经周围的组织中产生电场。当在电刺激期间获得特定的运动响应时,就确定了适当的针位置。要注射的局部麻醉剂的量根据技术而变化。随着溶液的注射,神经发生机械移位,运动反应丧失(Campoy et al. 2012)。在坐骨神经和股神经阻滞中可以看到该技术的例子,链接如下(https://wsava . org/committees/global-pain-Council/)。
超声引导技术
超声波检查可用于进行一些周围神经阻滞。与使用电神经刺激器类似,超声引导局部麻醉技术旨在减少提供有效神经阻滞所需的局部麻醉剂剂量,同时减少局部麻醉剂毒性的可能性并提高成功率。该技术可以允许在外周神经阻滞给药期间对神经、血管和周围结构进行可视化。这将减少并发症,包括神经损伤、血肿和出血。然而,它需要培训和昂贵/特殊的设备。关于这一主题的综述文章已经发表(Portela et al. 2018a,b)。
2.7辅助药物
辅助药物不被视为“独立”镇痛药,但可以与阿片类药物、非甾体抗炎药和局部麻醉剂一起纳入疼痛管理方案,或在上述镇痛药类别之一有禁忌症时作为替代品(Ruel & Steagall,2019)(表16)。

氯胺酮
作用方式:NMDA受体激活是中枢感觉启动和维持的主要因素之一。通过可逆地拮抗NMDA受体,氯胺酮调节中枢敏感性并发挥抗痛觉过敏作用。氯胺酮还可能具有免疫调节作用,并直接抑制促炎细胞因子的产生(Beilin et al. 2003)。
适应症:预防和治疗中枢性过敏,作为大型侵入性手术和创伤患者多模式围手术期疼痛管理计划的一部分。它也可以用于表现出严重痛觉过敏和异常性疼痛症状的慢性疼痛患者。术后镇痛和食欲改善已在接受手术的犬中得到证实(Wagner et al. 2002, Sarrau et al. 2007);然而,关于它对猫的止痛效果的数据是缺乏的。对于外伤患者,应在分诊后尽快开始治疗。
金刚烷胺
作用方式:抑制NMDA受体活性,类似于氯胺酮,但没有致幻作用。
适应症:涉及神经病理性成分的长期疼痛综合征。例如,患有OA相关疼痛的犬,单独使用NSAID不能很好地控制疼痛(Lascelles et al. 2008)。患有OA的猫的客户报告疼痛评分有所改善,但是当仅用金刚烷胺治疗时,它们表现出活动减少(Shipley et al. 2021)。金刚烷胺由肾脏排泄;因此,肾功能下降的动物应小心。
加巴喷丁类(加巴喷丁和普瑞巴林)
作用方式:两种药物相似,但尚未完全阐明;它可能通过改变钙通道和抑制脊髓背角谷氨酸和P物质释放来调节疼痛。普瑞巴林比加巴喷丁更能结合钙通道。
适应症:猫和犬的具有已知或潜在神经病理性成分(例如OA、癌症、糖尿病性神经疾病、骨盆创伤、截肢、椎间盘疾病)的慢性疼痛(第3.12章)。也用于减轻运输和医院访问期间的焦虑,并作为急性疼痛的辅助药物。在患有自然发生的神经性疼痛的犬中,当与基线相比时,单独加巴喷丁和加巴喷丁-美洛昔康的犬短暂疼痛量表评分明显较低,但与安慰剂相比则不显著(Ruel & Steagall 2019, Ruel et al. 2020)。这两种药物都可能与共济失调和镇静有关,这可能使管理复杂化并影响生活质量(Platt et al. 2006, Bleuer-Elsner et al. 2021)。患有慢性肾病的猫应考虑减少加巴喷丁的剂量,因为药物排泄可能受损(Quimby et al. 2022)。在人类中,术前给予加巴喷丁以提供术后镇痛和减轻焦虑。一些研究表明,在接受手术的犬和猫以及在运输和诊所就诊过程中的猫中存在类似的影响(Crociolli et al. 2015, van Haaften et al. 2017, Steagall et al. 2018)。一项研究还显示,服用普瑞巴林后,运输相关的压力和焦虑降低(Lamminen et al. 2021)。在接受前肢截肢手术的犬中,术前加巴喷丁加入到已经稳健的方案中,包括术中和术后芬太尼输注和其他镇痛药,未能在术后前三天提供显著的益处(Wagner et al. 2010)。
阿米替林
作用方式:三环类抗抑郁药(TCAs)阻断儿茶酚胺再摄取,从而增强疼痛抑制系统。阿米替林也具有NMDA受体拮抗剂特性。
适应症:具有已知或潜在神经病理性成分的慢性疼痛。TCAs也可以与环境强化联合使用,用于治疗患有炎症性肠病和猫下泌尿道疾病(FLUTD)的猫(Chew et al. 1998)。然而,对治疗的反应存在很大的个体差异,许多患有特发性FLUTD的猫在经过7天的治疗后(每只猫每24小时10mg)没有表现出改善(Kraijer et al. 2003)。另一方面,对患有难治性FLUTD的猫进行12个月的长期治疗,消除了护理人员观察到的下尿路疾病症状,血尿和蛋白尿减少。观察到镇静作用、体重增加和皮毛质量下降(Chew et al. 1998)。阿米替林的添加可能证明在治疗一些难治性慢性疼痛的病例中是成功的,但可用的证据有限。
其他抗抑郁药
尽管TCAs是用于治疗人类神经病性疼痛的最常用的抗抑郁药,但是已经研究了其他抗抑郁药,例如选择性5-羟色胺和去甲肾上腺素再摄取抑制剂(例如度洛西汀)和选择性5-羟色胺再摄取抑制剂(例如氟西汀),有强有力的证据表明前者有效,而后者无效。在兽医学中,这些药物已经在问题行为的背景下进行了评估,关于它们在疼痛管理中的功效的数据有限。
请注意,同时服用具有血清素作用的辅助镇痛药(如曲马多、阿米替林、米帕明、度洛西汀)可导致“血清素综合征”因此,在管理正在接受焦虑治疗和接受选择性5-羟色胺再摄取抑制剂、TCAs或单胺氧化酶抑制剂(如司来吉兰)等药物的疼痛患者时,应谨慎。血清素综合征的特征是神经肌肉活动过度、发热、心动过速、呼吸急促和激越(Mohammad-Zadeh et al. 2008, Indrawirawan & McAlees 2014)。
曲马多
作用方式:曲马多是一种中枢作用镇痛药,具有双重作用机制(弱μ阿片样物质激动剂和抑制血清素和去甲肾上腺素再摄取)以及其他机制。
适应症:用于与其他镇痛药联合治疗猫的急性(注射制剂)或慢性(口服制剂)疼痛(Evangelista et al. 2014, Monteiro et al. 2017, Guedes et al. 2018)。
犬和猫的区别:曲马多最重要的代谢产物O-去甲基曲马多(M1)与μ阿片激动剂作用有关。与犬相比,这种代谢物在猫体内产生的速度更快,据报道半衰期更长,清除速度更慢(Perez Jimenez et al. 2016)。犬不能产生显著浓度的O-去甲基曲马多,并且在患有OA (Budsberg et al. 2018)或术后疼痛(Donati et al. 2021)的犬中没有观察到镇痛作用。有充分的证据表明曲马多可用于猫(尽管在某些情况下苦味可能妨碍口服)。在犬身上使用曲马多的证据很少。因此,曲马多只能在药物供应有限的情况下用作犬的辅助镇痛剂(即,虽然预计不会对犬产生阿片样物质作用,但可能存在抑制血清素和去甲肾上腺素再摄取的潜在镇痛作用)。
2.8疼痛患者的非镇痛药物管理
糖皮质激素(GCs)
几乎没有证据支持在临床环境中使用这些药物进行镇痛;然而,它们的使用可以通过其抗炎特性缓解疼痛。这些药物更适用于过敏性和自身免疫性疾病(如免疫介导性贫血)和特定炎症性疾病(如炎症性肠病、脑膜炎)的治疗。正是GCs对减少前列腺素产生的作用,以及它们在缓解这些症状中的作用相结合,带来了疼痛的缓解。由于不良反应的发生率增加,GCs与NSAIDs的组合是禁忌的(Boston et al. 2003)。
吸入麻醉剂
这些用于动物的全身麻醉。麻醉深度可以预测,并迅速调整,心肺抑制是剂量依赖性的。这类药剂包括氟烷、异氟烷和七氟烷,但没有一种具有抗伤害特性。吸入性麻醉剂在全身麻醉期间会简单地阻断疼痛的感觉;如果没有使用止痛药物,病患醒来时会感到疼痛。
马罗匹坦
马罗匹坦是一种神经激肽-1受体(NK-1)拮抗剂,用于通过阻断中枢神经系统中胆碱能受体触发区的NK-1受体来治疗和预防呕吐。NK-1受体及其配体P物质存在于参与伤害性感受的脊髓感觉传入纤维中。对小鼠和兔的研究表明,NK-1受体拮抗剂持续诱导对内脏伤害性刺激的镇痛作用,但这一信息不应外推到小动物,因为临床镇痛似乎不相关。在犬猫静脉注射后,马罗匹坦可能会减少吸入麻醉剂的用量(Boscan et al. 2011, Niyom et al. 2013)。在这一点上,没有明确的证据表明马罗匹坦在临床环境中可以作为镇痛药使用(Kinobe & Miyake 2020)。马罗匹坦可减少呕吐,但不能消除恶心,并可能导致胃肠动力降低(Koh et al. 2014, Mikawa et al. 2015)。总的来说,该药物可以作为麻醉计划的一部分,以改善患者的住院体验,减少运输过程中的晕动病。
昂丹司琼
昂丹司琼是一种3型血清素(5-HT3)受体拮抗剂,是一种有效的止吐药和抗恶心药(Santos et al. 2011, Foth et al. 2021)。虽然马罗匹坦和昂丹司琼没有被证实的镇痛作用,但它们仍然是预防呕吐副作用的整体患者管理中的重要组成部分,从而提高患者的舒适度。
乙酰丙嗪(ACP)
乙酰丙嗪是兽医中最广泛使用的镇静剂之一;它没有止痛的特性。ACP的给药减少了注射和吸入麻醉剂的需求。在高剂量下或在低血容量动物中,它可引起临床上显著的低血压。乙酰丙嗪广泛用于围手术期(精神安定痛觉过敏),可能导致继发于外周血管扩张和对下丘脑的中枢作用的低体温症。
2.9物理康复
物理康复包括对关节内、关节囊、韧带、肌肉、肌筋膜以及中枢和外周神经组织中的肌肉骨骼和神经损伤进行临床评估和治疗。评估姿势、步态、功能、力量、肌肉灵活性、被动活动范围和关节灵活性,以制定治疗计划(Millis & Levine,2014年)(https://www.youtube.com/watch?v=69YWXX_zUL8)。物理疗法、手工疗法和治疗性锻炼可用于治疗疼痛(图27)。治疗频率、强度和持续时间取决于目标组织的愈合能力和损伤的慢性程度。


图27.使用平衡盘进行理疗运动的犬的例子。图由Bonnie Wright提供
治疗性运动
运动改善血液和淋巴流动,增加软组织对骨骼和脊柱结构的支持,增加肌腱和韧带的柔韧性,并改善软骨健康。可以教育病患的看护者在家庭环境中进行治疗练习。简单的运动,如静态负重,可以在受伤的急性期使用,随着愈合的进展和力量的提高,强度逐渐增加。在人类中,强化和有氧运动可以缓解疼痛,止痛效果与非甾体抗炎药相同或更好(Polaski et al. 2019)。
物理疗法
物理疗法可用于减轻疼痛、促进软组织愈合、改善肌肉延展性和促进肌肉强化。
热疗.对组织加热增加了扩张性和血液流动,以促进愈合。在疾病状态的早期,热可能是伤害感受性的。在慢性状态下,一旦炎症消退;肌肉和筋膜的限制占主导地位,热可以有止痛效果(McCarberg & O'Connor 2004)。
冷疗.参见第2.10章。
光生物调节(低强度激光/光).使用红色/近红外光的光子应用导致减少炎症和止痛。存在不同的等级,剂量基于波长、辐射功率、辐照度、流量和治疗区域。光生物调节在患有肘部或髋关节疼痛(10至20J/cm2)的犬中显示出止痛功效(Looney et al. 2018, Alves et al. 2022)。
电刺激.经皮神经电刺激(TENS)为大约一半的中度疼痛患者提供了镇痛作用(Rushton 2002)。基于频率(每秒脉冲数)、强度(脉冲幅度)和脉冲持续时间(输送电流的周期),对每个患者的治疗进行滴定。
脉冲电磁疗法.非热、非侵入性电磁疗法的应用减少了人的膝骨性关节炎疼痛,改善了犬在半椎板切除术后的功能预后(Nelson et al. 2013, Alvarez et al. 2019)。
冲击波治疗.使用高强度声波使组织变形导致新血管形成、慢性炎症逆转、刺激胶原蛋白产生、治疗肌腱和韧带损伤以及提供短期和长期镇痛(Chamberlain & Colborne 2016)。研究发现,犬在膝关节手术后改善了肢体使用,对患有腰痛的人有长期益处(Barnes et al. 2019, Walewicz et al. 2019)。
触发点压力.触发点位于肌肉纤维的绷紧带内(疼痛、坚硬的结节状结构)。可以使用治疗性激光、电疗或物理或手动疗法(如注射局部麻醉剂或针灸(干针))对其进行刺激(Wall 2014)。虽然兽医方面的数据有限,但针灸的使用是首选。
按摩.参见第2.15章。
2.10冷疗
它是什么
冷疗是一种医学上有用的非药物止痛工具,科学上合理,全球可用,不受法规限制(Wright et al. 2020)。它包括通过纸杯、水桶和袋子局部应用冰或冷冻基质,或使用冷压缩装置和循环套筒(图28)。它应该被充分地应用于目标组织并持续足够长的时间。
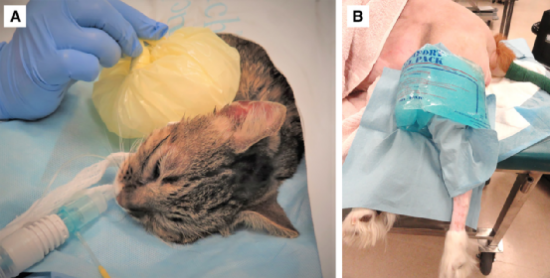
图28.冷疗的例子,冰袋从不与皮肤直接接触。冰袋和皮肤之间应该有一层(如纸或布)。(A)在完全耳道消融后立即给猫注射。无菌纱布垫用来保护皮肤。(B)一只刚做后腿膝关节的犬。手术单被用来保护皮肤。图(A)转载自Steagall et al. (2022)。图(B)由Sheilah Robertson提供。
它是如何工作的
对皮肤进行冷敷可以降低皮下组织2到4cm深度的温度。这导致组织伤害感受器的激活减少,沿外周轴突的传导速度减慢(冷诱导的神经麻痹)(Malanga et al. 2015)。特定的外周冷敏感离子通道有助于减少伤害性信号和激活抑制性中间神经元(Liu et al. 2013)。冷疗还通过交感神经介导的血管收缩减少水肿,并减少肌肉痉挛(Lee et al. 2002)。急性和慢性疼痛患者可能会出现肌肉痉挛,这是导致不适的主要原因(Malanga et al. 2015)。
适应症和考虑
作为止痛方案的一部分,建议对任何手术切口进行冷疗。每6至8小时冷敷15至20分钟可在手术后立即进行,并在手术后持续几天;这项技术可以传授给护理人员,并在出院后继续使用(Wright et al. 2020)。
在慢性疼痛伴有炎症或肌肉痉挛的情况下,冷疗也可能有价值。与任何药物或医疗程序一样,它具有剂量相关、时间相关和疾病相关的效应,这些效应因患者而异。因此,应该在仔细考虑它对每个人的潜在价值后使用它。
注意事项包括避免长时间使用造成神经损伤,或将其应用于无感觉或血流不畅的区域(如末端)。应在冷材料和皮肤之间放置适当的屏障(如毛巾)。应该避免未消毒的表面接触新的手术切口。在1至2小时内,冰敷时间不应超过20分钟。大多数患者在短暂的不适(不应持续超过2分钟)后接受冷感觉(Francisco et al. 2018)。患者最初可能会对冷疗产生负面反应,但随着组织变得不敏感,通常会很快表现出接受。然而,冷异常性疼痛可发生在慢性疼痛综合征中,对于出现冷刺激过度刺激或继续试图避免治疗的患者,应停止治疗。
2.11大麻素
内源性大麻素系统
在所有脊椎动物中,内源性大麻素系统与其他神经调节系统一起工作,如血清素能、多巴胺能、去甲肾上腺素能和阿片能系统。这些系统相互作用,努力维持体内平衡(McPartland et al. 2014)。几种形式的物理医学,如运动、针灸和饮食,也有助于改变内源性大麻素系统(Howlett & Abood 2017,Toczek & Malinowska 2018)。
大麻素受体(CB)是细胞膜和神经突触前末梢上发现的神经调节G蛋白偶联受体。有两种公认的CB: CB1(主要在神经系统上)和CB2(广泛分布并与免疫细胞相关)。大麻素有三种类型:内源性大麻素(由身体产生)、植物性大麻素(由植物产生)和合成大麻素。这些分子改变外周和中枢的伤害感受信号。通过其神经胶质作用,它们具有抗痛觉过敏作用,并可减少神经退行性疾病(如退行性脊髓病)(Fine & Rosenfeld 2013, Fernandez-Trapero et al. 2017)。多种内源性和外源性配体被认为能结合或修饰CB受体。
外源大麻素
植物大麻素主要来自大麻,通常比合成化合物更加多样。大麻酚(CBD)和δ-9-四氢大麻酚(THC)是研究最多的两种植物大麻素分子;然而有超过180种化合物。监管机构批准的药物来自生物来源,并减少到一个或两个分子。植物来源的大麻素含有萜烯和类黄酮,它们也具有生物效应。各种各样的化合物导致了不同植物大麻素的复杂性和不同效果,并且缺乏用于监管和研究的商业可用产品的标准化。
CBD通常在兽医中用于CB2受体的镇痛和免疫调节作用。精神作用和镇静作用最小,而药物作用相对可预测(Gamble et al. 2018)。THC是CB1受体的强激动剂,尽管它也结合CB2。它与精神作用、焦虑、心动过速和外周血管舒张有关,因此THC很难在兽医物种中用于医疗用途。然而,当与CBD联合使用时,少量的THC可以显著提高疗效(Vaughn et al. 2020)。
CBD通常在兽医中用于CB2受体的镇痛和免疫调节作用。精神作用和镇静作用最小,而药物作用相对可预测(Gamble et al. 2018)。THC是CB1受体的强激动剂,尽管它也结合CB2。它与精神作用、焦虑、心动过速和外周血管舒张有关,因此THC很难在兽医物种中用于医疗用途。然而,当与CBD联合使用时,少量的THC可以显著提高疗效(Vaughn et al. 2020)。
大麻和大麻素
印度大麻和大麻都是大麻属植物。区别在于四氢大麻酚的含量(大麻中四氢大麻酚的干重< 0.3%)(Deabold et al. 2019)。由于杂交,植物变得极其多样;因此,从医学角度来看,个体物种并不重要(Solymosi & Kofalvi 2017)。常见植物品种的不同效果基于活性大麻素、萜烯和类黄酮的比例(Piomelli & Russo,2016年)。分析证书提供了给定产品的信息(Wakshlag et al. 2020)。
大麻素的临床研究
目前不可能向兽医推荐一种关于大麻素的通用方法。法律差异很大,从法律风险很小的地区,到规定或销售药物属于刑事犯罪的地区。这些化合物正在被广泛使用,并且通常是在没有兽医监督的情况下获得的,但是兽医专业人员应该起到保护和提供建议的作用,至少在减少伤害方面。继续教育培训旨在提高这方面的知识。
中毒在犬中被广泛报道,尤其是四氢大麻酚。临床症状的严重程度各不相同,包括中枢神经系统抑制、焦虑、感觉过敏、漏尿、心动过速和死亡。大麻素也是细胞色素P450酶(尤其是CBD)的有效抑制剂。与其他药物合用时应谨慎,并应进行监测以评估肝酶和功能的变化。当大麻素与其他通过钙通道发挥作用的药物(如加巴喷丁)联合使用时,应减少剂量,以避免过度镇静。同样,四氢大麻酚的血管舒张作用可以改变基础疾病状态,如肾脏和心脏状况(Ho et al. 2019)。
内源性大麻素系统是一个体内平衡系统,个体可能具有极其不同的“基线”活性,导致治疗的不可预测性。建议从低剂量开始使用植物大麻素,并在几周内逐步滴定。在患有OA的犬中,通常每天口服两次剂量为2 mg/kg的CBD油,并且已经报道了一定程度的疗效;在一些犬中发现肝酶升高(Gamble et al. 2018, Brioschi et al. 2020, Vaughn et al. 2020)。猫的功效数据尚不可用,但它们的药代动力学似乎与犬有很大不同(Deabold et al. 2019)。新生儿的内源性大麻素系统可能不成熟,肝功能也不成熟,因此怀孕、哺乳动物和8周龄以下的动物应避免使用大麻素。