摘要
背景:宠物犬猫粪便检查是宠物医院的常规检查的关键组成部分;然而,其准确度受到诊断方法和执行检测的人员经验水平的影响。VETSCAN IMAGYST系统的开发旨在提供更简单方便且较少受检查者技能影响的粪便检查方法。该系统由三个部分组成:样本制备装置、自动显微镜扫描仪和分析软件。本研究的目的是定性评价VETSCAN IMAGYST系统检测猫寄生虫(钩虫和弓首蛔虫)和原生动物寄生虫(等孢子球虫和贾第鞭毛虫)的性能,并评估和比较VETSCAN IMAGYST离心浮选法与参考实验室离心和被动浮选法的性能。
方法:为评价VETSCAN IMAGYST系统的扫描和算法组件的诊断性能,通过采用VETSCAN IMAGYST离心浮选技术处理从犬和猫中采集预先筛选的粪便样本制备粪便载玻片,然后经由算法和寄生虫学家进行检查。为了评估VETSCAN IMAGYST离心浮选技术的性能,计算了诊断敏感性和特异性,并与常规浮选技术进行了比较。
结果:VETSCAN IMAGYST算法的性能与寄生虫专家的评价密切相关,对靶标寄生虫的敏感性为75.8-100%,特异性为93.1-100%。对于每个载玻片中含有50个或更少虫卵的样本,靶标寄生虫的Lin一致性相关系数范围为0.70-0.95。对于靶标寄生虫,VETSCAN IMAGYST离心浮选法的结果与传统离心浮选法的结果具有良好的相关性:敏感性为65.7–100%,特异性为97.6–100%。采用常规被动浮选法与常规离心浮选法所得结果相似:敏感性为56.4-91.7%,特异性为99.4-100%。
结论:采用VETSCAN IMAGYST粪便制备技术的VETSCAN IMAGYST扫描和算法系统显示出与采用常规粪便浮选技术的寄生虫学家检查相似的定性性能。鉴于VETSCAN IMAGYST系统的深度学习性质,预期其性能会随着时间推移而改善,这使得兽医诊所能够准确有效地进行粪便检查。
关键词:深度学习、粪卵鉴定、兽医寄生虫学诊断、钩虫、猫弓首蛔虫、等孢子球虫、贾第鞭毛虫、卵囊、包囊
*通信作者:yokon@okstate.edu;yoko.nagamori@zoetis.com
1俄克拉荷马州立大学兽医学院兽医病理学系,Stillwater,OK 74078,USA
作者信息完整列表可在文末获取
1、背景
随着宠物拥有量的整体增长,美国境内家猫拥有量也不断增加。2017-2018年,美国有多达4710万户拥有至少1只猫,76%的猫主人认为其猫为“家庭成员”[1]。尽管研究报告胃肠道寄生虫病在猫中很常见[3-8],然而,与犬相比,猫接受的兽医医疗或服务通常较少[2]。最近的一项回顾性研究表明在12年期间,客户拥有猫的肠道寄生虫感染患病率显著增加(2007年为19.0%,2018年为32.5%;P<0.0001)[7]。多数人从收容所或通过救援或收养流浪动物获得猫[1],但这些猫群具有较高的寄生虫感染患病率,范围为31.8-67.2%[3-5,7,8]。在猫中检出的最常见线虫为钩虫和猫弓首蛔虫[3–9]。在北美检出的猫钩虫的主要类型为管形钩口线虫和巴西钩口线虫[10]。由于猫钩虫和弓首蛔虫是引起人畜共患病的寄生虫[11-18],因此对猫进行常规粪便检查,并在必要时进行治疗以保持猫及其主人的健康非常重要。
北美家犬猫中最常检出的原生动物寄生虫为等孢子球虫(正式名称为等孢球虫属)和贾第鞭毛虫[3,5–8,19–25]。评价猫粪便样本的研究已报告等孢子球虫和贾第鞭毛虫的患病率范围分别为3.8-26.0%和1.2-9.9%,其中收容所猫的患病率最高[3,5-8,19,20,24,25]。据报道,犬等孢子球虫和贾第鞭毛虫的患病率范围分别为0.5-10.4%和3.3-13%[8,19,21-24,26-31]。等孢子球虫卵囊和贾第鞭毛虫包囊/滋养体尺寸较小,通过显微镜检测具有挑战性,特别是当粪便样本含有少量卵囊、包囊或滋养体时。此外,间歇性排出贾第鞭毛虫包囊/滋养体使得诊断贾第鞭毛虫病更难[10,32–35]。
用于检测犬猫胃肠道寄生虫证据的粪便检查被广泛认为是常规兽医护理的重要组成部分,可用于维持宠物健康和鉴定引起人畜共患病的寄生虫[36]。然而,粪便检测的准确性和有效性可能受到许多因素的影响,例如方法学差异和执行检测的人员的经验水平[36–38]。值得注意的是,贾第鞭毛虫已被确定为宠物医院中通过粪便学诊断特别困难的寄生虫[36]。最近开发并引入了用于粪便检查中鉴定寄生虫的计算机算法,旨在提高诊断犬猫寄生虫疾病的准确度和一致性[39–42]。
新型VETSCAN IMAGYST系统以有序且不复杂的方式评价粪便样本是否有寄生虫感染证据,这在很大程度上并不取决于检查者的经验水平。该系统能够可靠地检测出84只犬和16只猫粪便样本中的4种靶标寄生虫(钩虫、弓首蛔虫、鞭虫和绦虫),且结果与动物粪便检查后寄生虫专家报告的结果密切相关(4种靶标寄生虫的皮尔逊相关系数为0.83–0.99)[40]。VETSCAN IMAGYST系统由三个主要部分组成:样本制备装置、自动显微镜扫描仪和使用深度神经网络的数据分析软件(图1)。VETSCAN IMAGYST系统采用了一种深度学习客观检测算法,该算法使用卷积神经网络鉴别可自动学习类别之间最具区分性特征的卷积层(图2)。该算法为在每份样本制备物中识别出的图像分配一个概率评分,即虫卵属于软件先前经训练/校准识别的寄生虫属/类群的概率评分。通过利用专家表征的样本的训练过程,开发了一种能够感知和区分粪便浮选载玻片上单个寄生虫卵和非寄生虫物形态的成熟算法模型。一旦模型足够成熟,对几个评价数据集进行测试,以确保最终最有前景的模型可推广至其他相似领域。
本研究是先前发表的VETSCAN IMAGYST研究[40]的扩展研究,有两个额外的主要目的。首先,定性评价VETSCAN IMAGYST系统在自然感染犬猫粪便中检出和正确鉴别猫钩虫卵、猫弓首蛔虫卵、等孢子球虫卵囊和贾第鞭毛虫包囊的诊断性能,并与采用常规样本制备方法的专家手动鉴别进行比较。其次,比较VETSCAN IMAGYST离心制备法与标准离心和被动浮选法对4种靶标寄生虫(猫钩虫、猫弓首蛔虫、等孢子球虫和贾第鞭毛虫)的诊断性能。

图1 ▲VETSCAN IMAGYST系统由三个主要部分组成:样本制备装置、数字显微镜扫描仪以及数据分析和报告
2、方法
2.1
粪便样本采集
如前文所述,使用威斯康星粪卵计数法对向俄克拉荷马州立大学俄克拉荷马动物疾病诊断实验室提交的客户拥有的和收容所的犬猫的粪便样本进行处理,以进行卵、卵囊和包囊检出[10,40]。共采集100份粪便样本,重量至少为8g,经确证至少有1种靶标寄生虫呈阳性:(1)猫钩虫,(2)猫弓首蛔虫,(3)猫等孢子球虫,(4)犬和猫贾第鞭毛虫;同时,还有10份猫样本,其任何靶标寄生虫检测均为阴性。将样本作为阳性或阴性纳入相关分析;含多个靶标寄生虫的样本在一次以上分析中计为阳性,一些样本在一次以上分析中计为阴性。对于等孢子球虫分析,纳入了采用相同的样本采集标准从第一个月至几个月期间分离的第二次采集的另外100份粪便样本,包括犬样本。表1总结了每次评价期间评估的筛选阳性和阴性样本数量。VETSCAN IMAGYST算法和样本制备评估使用了不同的参考方法;因此,不同评价的阳性和阴性结果总数不同。为了保持寄生虫成分诊断形式的形态学完整性,将所有样本保存在4°C条件下直至研究。对于38份样本,加入低水平福尔马林溶液(作为固定剂),以确保寄生虫成分的完整性。
2.2
VETSCAN IMAGYST扫描仪和算法
之前已经描述了VETSCAN IMAGYST系统[39]。简言之,使用提供40倍有效分辨率的Motic EasyScan One数字载玻片扫描仪(Motic,Kowloon Bay,Hong Kong)读取含有粪便样本的载玻片。然后,扫描后的图像自动上传至云中,并使用基于使用自适应矩估计(Adam;一种对随机目标函数进行一阶梯度优化的算法)优化器[44](Techcyte,Lindon,UT)的You only look once(YOLOv3)模型[43]开发的更新深度学习的对象检测算法版本3033进行分析。使用之前由VETSCAN IMAGYST系统采集并保留的约2000–5500张图像进行8个时段的多次训练以提高算法性能后,选择版本3033。每个时段训练两次,在每个标签周围随机翻译416×416像素区域,用于进一步训练。定位和分类目标对象后,生成的图像可在VETSCAN IMAGYST平台上查看,并生成可下载的便携式文件格式报告(图1)。VETSCAN IMAGYST分析软件还具有对靶标寄生虫进行计数的定量能力。在本研究中,在含≤50个寄生虫元素/g粪便的样本中对该定量能力进行了部分评价,因为我们的主要目的是定性评价VETSCAN IMAGYST系统检出和正确鉴定靶标寄生虫的诊断性能。
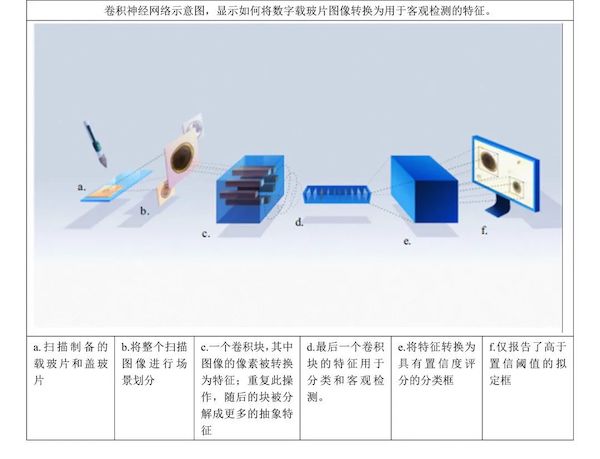
图2 ▲VETSCAN IMAGYST算法的卷积神经网络和客观检测过程示意图
表1 ▼基于初始表征按靶标寄生虫列出的纳入本研究的粪便样本总结
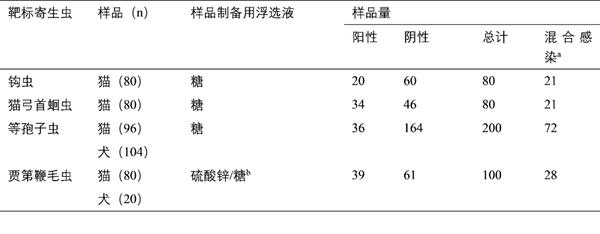
a 混合感染是指超过1个靶标寄生虫呈阳性的样本
b 硫酸锌溶液用于贾第鞭毛虫样本;糖液用于剩余样本
2.3
VETSCAN IMAGYST算法性能评估
为定性评价VETSCAN IMAGYST系统的扫描和算法组分鉴别诊断形式靶标寄生虫的能力,如Nagamori等人之前所述[40],使用VETSCAN IMAGYST离心浮选技术为每份预筛选粪便样本制备载玻片。简言之,随机检查预先筛选的粪便样本。采用由Apacor mini Parasep SF(Apacor,Wokingham,UK)专门重新设计并生产的VETSCAN IMAGYST粪便制备装置执行VETSCAN IMAGYST离心法。VETSCAN IMAGYST粪便制备装置由两个试管组成:带有样本勺的样本管(可以容纳约1 g粪便)和含下列两种浮选液的采集管:贾第鞭毛虫样本用硫酸锌溶液(比重:1.18),其余样本(包括钩虫、弓首蛔虫、等孢子球虫和阴性样本)用糖溶液液(比重:1.25)。选择糖溶液进行当前分析,因为其比一些用于浮选浓密寄生虫卵的盐溶液更有效、便宜且更容易维护粪便载玻片样本,因为其不会快速结晶[10]。将样本管和采集管牢固拧在一起,振摇,以300-500相对离心力(rcf)离心2分钟。离心后,从采集管上拧下样本管。使用移样环从浮选液顶部收集诊断形式寄生虫,并将其转移到显微镜载玻片上(图3)。放置贴有IMAGYST标签的盖玻片,以便能够正确读取IMAGYST标签,确保将标记的盖玻片准确放置在载玻片上。将载玻片置于载玻片托盘中,然后将其插入自动显微镜扫描仪中,将得到的数字扫描图像上传至基于云的服务器,以便进行分析和生成结果。
由两名技术人员进行VETSCAN IMAGYST粪便制备。使用VETSCAN IMAGYST系统分析载玻片后,两名寄生虫学家和一名技术人员(均具备丰富的诊断寄生虫学经验)在100×、200×和400×放大倍数下对每个载玻片进行显微镜评价。根据虫卵、卵囊和包囊的形态鉴别寄生虫[10]。在寄生虫学家和技术人员的手动检查期间,当每个靶标寄生虫最多存在50个虫卵、卵囊或包囊时,对整个载玻片进行计数。若负荷较高(>50)则估计数量,关于虫卵,对于51-250个虫卵/克粪便(EPG)的载玻片,记录为“中等”,对于>250个EPG的载玻片,记录为“高”。另一方面,VETSCAN IMAGYST算法提供了计数,与虫卵负荷无关。对VETSCAN IMAGYST算法和专家显微镜检查所得结果进行比较和统计分析。对于贾第鞭毛虫粪便样本,对>10个包囊/g粪便(CPG)样本子集进行了额外分析。
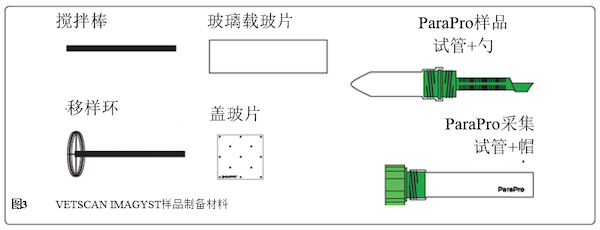
图3 ▲VETSCAN IMAGYST样本制备材料
2.4
样本制备方法评估
通过与采用目视显微镜的常规离心浮选和被动浮选方法进行比较评估VETSCAN IMAGYST离心技术的性能(敏感性和特异性)。对于每份粪便样本,采用3种不同的样本制备技术制备载玻片:VETSCAN IMAGYST离心浮选、常规离心浮选和使用OVASSAY Plus Kit粪便浮选装置(Zoetis,Parsippany Troy Hills,NJ)的常规被动浮选。如上所述,两名技术员采用VETSCAN IMAGYST离心浮选技术制备载玻片。之前已经描述了参考离心浮选技术的流程[40]。简言之,对于贾第鞭毛虫样本用33%硫酸锌溶液(比重,1.18)以及其余样本用Sheather糖液(比重,1.25),混悬1g粪便,然后混匀并置于15ml离心管中向试管中加入浮选溶液,直至形成凸面弯月面,然后加上盖玻片,并在Centra CL2离心机(Thermo Fisher Scientific,Waltham,MA)中以约440 rcf离心样本5分钟。取下盖玻片并将其置于玻璃载玻片上之后,进行显微镜检查[10]。按照生产商说明[45],使用含33%硫酸锌溶液(比重,1.18)的OVASSAY Plus Kit粪便浮选装置进行被动粪便浮选试验。数名学生工作人员采用常规离心和被动粪便浮选法制备粪便载玻片,并由3名专家按以上所述对所有载玻片进行显微镜检查。没有限制或记录专家进行显微镜检查的持续时间。将VETSCAN IMAGYST离心浮选法与两种参考方法(传统离心和OVASSAY被动浮选法)的诊断性能进行了比较。
2.5
统计分析
观察到任何寄生虫元素或在单独分析中记录到贾第鞭毛虫包囊数>10 CPG的样本被视为阳性。构建二乘二表,采用95% Jeffreys置信区间估计值计算敏感性和特异性。当3名专家在显微镜下进行计数所得每个载玻片≤50个虫卵、卵囊或包囊时,计算出Lin一致性相关系数(ρc)。当估计每个载玻片>50个虫卵/卵囊/包囊时,数据未包括在相关性分析中。使用SAS版本9.4M6(SAS Institute,Cary,NC)进行统计分析。
3、结果
3.1
算法性能
将VETSCAN IMAGYST系统生成的结果与专家记录的结果进行比较,以评估VETSCAN IMAGYST扫描仪和算法在鉴别靶标寄生虫的虫卵、卵囊和包囊方面的性能(表2和图4)。与专家评估相比,VETSCAN IMAGYST系统对4种靶标寄生虫的诊断敏感性和特异性范围分别为75.8-100%和93.1-100%。12/33份(36%)贾第鞭毛虫样本含有非常少的包囊,即≤10 CPG。从分析中排除≤10 CPG的贾第鞭毛虫样本后,贾第鞭毛虫的诊断敏感性显著增加至95.2%(95%置信区间:79.8-99.5%)。对≤50 EPG、OPG或CPG的样本进行了定量比较,对于各靶标寄生虫,VETSCAN IMAGYST诊断结果与专家诊断结果非常匹配(猫钩虫:ρc为0.95,猫弓首蛔虫:ρc为0.89,等孢子球虫:ρc为0.80,贾第鞭毛虫:ρc为0.70)。
表2 ▼算法性能分析:比较专家(参考)报告的结果与VETSCAN IMAGYST扫描仪和算法针对采用VETSCAN IMAGYST离心浮选方法制备的样本报告的结果的诊断敏感性和特异性
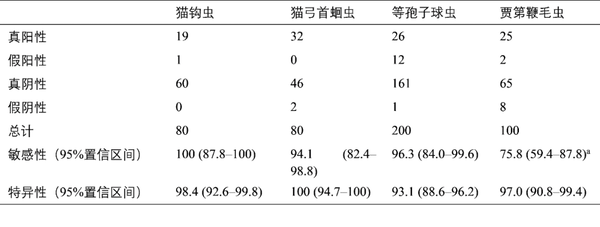
a 36%(12/33)贾第鞭毛虫样本含≤10个包囊/g粪便(CPG);对>10 CPG的贾第鞭毛虫样本的诊断敏感性增加至95.2%(95%置信区间:79.8-99.5%)
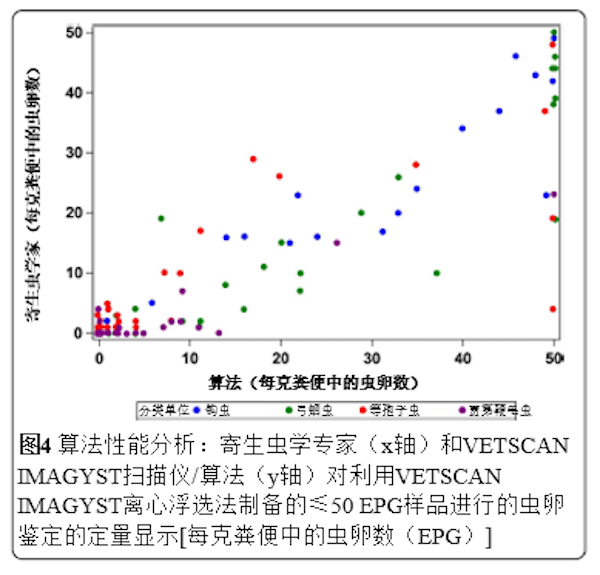
图4 ▲算法性能分析:寄生虫学专家(x轴)和VETSCAN IMAGYST扫描仪/算法(y轴)对利用VETSCAN IMAGYST离心浮选法制备的≤50 EPG样本进行的虫卵鉴定的定量显示[每克粪便中的虫卵数(EPG)]
3.2
样本制备性能
4、讨论
本研究是第二项研究,证明了集成深度学习客观检测算法的VETSCAN IMAGYST系统能够在通过自动显微镜扫描的粪便浮选载玻片上成功识别和鉴别犬和猫诊断形式的胃肠道寄生虫。尽管我们之前的研究评价了VETSCAN IMAGYST系统在84份犬和16份猫粪便样本中检测钩虫、弓首蛔虫、鞭虫和绦虫的虫卵的性能[40],但本研究评估了该系统在104份犬和96份猫粪便样本中检测猫线虫-钩虫和猫弓首蛔虫的虫卵和原生动物寄生虫-等孢子球虫卵囊以及原生动物寄生虫-贾第鞭毛虫包囊的能力,从而对该新型系统进行了更全面的分析。
尽管家养犬猫均属于食肉目,但犬归类为犬型总科,猫归类为猫总科[46,47]。犬科动物饮食范围从草食性到杂食性;然而,所有猫都需要严格的肉食饮食[47]。动物源性高蛋白饮食对于家猫来说是必需的,以满足一些营养需求,例如牛磺酸以及花生四烯酸和维生素A[47]。由于其饮食,猫的粪便样本通常含有大量脂肪,并且具有柔软性、粘性和粘土样稠度,这通常使得读取粪便载玻片变得更加困难,或有时无法读取粪便载玻片,因为更多的碎片与脂肪一起漂浮,特别是在离心浮选技术中使用粘性糖液时。修改粪便浮选程序,包括初始水洗,其中在初始旋转后弃去上清液,并用浮选溶液重悬沉淀物,以去除多余的脂肪、粘液和碎屑(双离心粪便浮选技术)[10]。在本研究中,VETSCAN IMAGYST离心浮选法从猫粪便中检出寄生虫成分,VETSCAN IMAGYST扫描仪和算法成功捕获并鉴别靶标寄生虫(图5)。
表3 ▼样本制备分析:比较VETSCAN IMAGYST离心浮选(VS-Ic)和OVASSAY被动浮选(O-pf)方法与常规离心浮选方法(参考)的诊断灵敏度和特异性;由专家读取所有载玻片
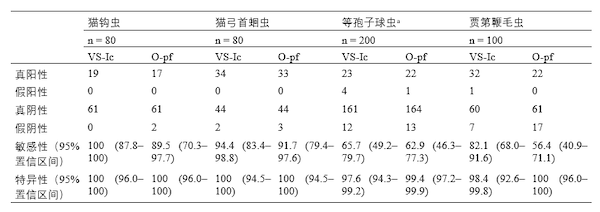
a 等孢子球虫结果是2项具有相同样本采集标准的独立研究的组合。等孢子球虫属包括犬等孢子球虫、俄亥俄等孢子球虫、猫等孢子球虫和芮氏等孢子球虫。
据我们所知,本报告是第一份证明VETSCAN IMAGYST系统能够检出并准确检测原生动物寄生虫(即等孢子球虫卵囊和贾第鞭毛虫包囊)的报告。虽然由于免疫力迅速产生,通常认为在成年犬猫中,球虫病是自限性感染[18],但等孢子球虫仍是幼犬和幼猫体内普遍存在的重要病原体,感染等孢子球虫通常导致腹泻、腹痛、厌食、血性腹泻、贫血,严重情况下甚至死亡[10,17,48]。由于等孢子球虫在致病性肠道阶段快速复制,大量卵囊在宿主粪便中排泄,导致环境污染,因此认为至关重要,强烈建议在出生后第1年期间对幼犬和幼猫进行至少4次离心粪便检查,以便在感染早期治疗等孢子球虫[48,49]。在犬和猫中,通常诊断出不同种类的等孢子球虫:犬:犬等孢子球虫和俄亥俄等孢子球虫;猫:猫等孢子球虫和芮氏等孢子球虫。犬等孢子球虫和猫等孢子球虫的卵囊略大,大小约为38-51×27-39 µm,俄亥俄等孢子球虫和芮氏等孢子球虫大小约为17-27×15-24 µm[10]。由于球虫卵囊小于寄生蠕虫虫卵,所以很容易忽略等孢子球虫,特别是当粪便载玻片上的卵囊数量少,并使用不准确的显微镜聚焦进行检查时。VETSCAN IMAGYST系统正确鉴别出犬和猫粪便样本中所有4种等孢子球虫属的卵囊,并成功报告为等孢子球虫(球虫)(图5)。
相比专家报告的结果,VETSCAN IMAGYST扫描仪和算法对贾第鞭毛虫样本的诊断敏感性和特异性分别为75.8%和97.0%(表2)。如前所述,许多客观检测算法模型的常见挑战是精确定位和区分小物体,如贾第鞭毛虫包囊[40]。然而,深度学习算法的性质意味着其性能随着进一步训练而持续改善。需要注意的是,从分析中删除≤10 CPG的12份贾第鞭毛虫样本可使诊断敏感性显著增加至95.2%;使用目视显微镜检查载玻片时,检测到此类少量包囊非常困难。此外,这些贾第鞭毛虫载玻片的CPG检查和计数由经过培训的诊断寄生虫学家仔细进行(没有时间限制),与技术人员在日常兽医实践中通常获得的诊断性能相比,其诊断性能很可能较高。
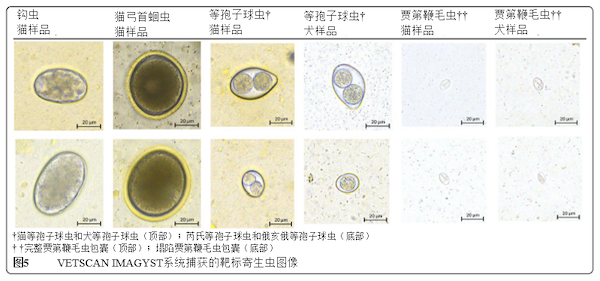
图5 ▲VETSCAN IMAGYST系统捕获的靶标寄生虫图像
通常认为通过显微镜检查检测贾第鞭毛虫包囊和滋养体是诊断贾第鞭毛虫病最敏感的技术,因此,需要大量的培训和经验来确诊本病[10]。通过粪便检查鉴别贾第鞭毛虫感染具有挑战性,因为除了其大小较小和透明度较高,贾第鞭毛虫包囊和滋养体间歇性脱落在粪便中,可能需要多次粪便检查以排除感染。通常需要采集新鲜粪便样本(最好在排便后30分钟内采集)以检测活动滋养体;然而,贾第鞭毛虫包囊和滋养体相当脆弱,其形状在浮选溶液中易于变形[10]。首选33%硫酸锌溶液(比重,1.18),并推荐该溶液用于检测贾第鞭毛虫包囊,因为其他浮选溶液可迅速引起贾第鞭毛虫包囊渗透损伤,从而增加在粪便载玻片上观察到贾第鞭毛虫包囊的难度[10,34,50,51]。在本研究期间,VETSCAN IMAGYST系统能有效识别和鉴别完整和塌陷的贾第鞭毛虫包囊(图5)。不仅建议在有症状的犬和猫中进行贾第鞭毛虫检测,还建议在新引入到有其他无感染宠物的家庭的犬和猫中进行贾第鞭毛虫检测,因为许多贾第鞭毛虫感染可能无症状[10,32,48]。由于没有完美的浮选溶液来检出所有不同类型的寄生虫[10],因此在选择一种浮选溶液用于一般用途时,考虑该溶液的优点和缺点非常重要。一些专家建议使用Sheather糖溶液和33%硫酸锌溶液进行两次离心浮选试验,以实现更广泛的胃肠道寄生虫检测。如果怀疑贾第鞭毛虫,也应使用糖浮选液对粪便样本进行分析,以检查其他寄生虫。
也可采用贾第鞭毛虫特异性粪原抗原检测试验检测贾第鞭毛虫[35,48]。然而,当不与传统显微镜技术联合使用时,抗原检测在不再感染贾第鞭毛虫的动物中可能会提供假阳性结果,因为在寄生虫消除后数周甚至数月期间存在持续抗原排泄[52,53]。鉴于贾第鞭毛虫的现行院内诊断方法存在缺陷,使用深度学习算法平台(如VETSCAN IMAGYST系统)可为临床医生提供极佳的附加或替代诊断工具,以帮助鉴别可能遗漏的贾第鞭毛虫病例。
本研究中对VETSCAN IMAGYST离心浮选样本制备方法的性能评价有限,因为4种靶标寄生虫的真阳性数量处于中等水平以及非均匀粪便样本的固有子采样变异性(已在先前出版物中充分记录)[54]。对于虫卵数较低(即≤50 EPG)的弓首蛔虫和鞭虫样本,Kochanowski等人[54]观察到较宽的变异系数范围(在31-254%之间)。尽管存在这些局限性,本研究中VETSCAN IMAGYST离心浮选法的性能仍与传统离心浮选法相当,对4种靶标寄生虫的诊断敏感性和特异性范围分别为65.7-100%和97.6-100%(表3)。此外,为提高VETSCAN IMAGYST离心浮选法的诊断敏感性而考虑进行的一项潜在改进是延长离心时间。先前研究指出,当离心时间从1分钟至3分钟增加至4分钟或5分钟时(转速不变),以264×g离心获得的虫卵检出率显著改善,但当离心时间延长至10分钟或20分钟时,未观察到虫卵检出率变化[37,55]。
如表3所示,VETSCAN IMAGYST离心技术的诊断敏感性和特异性略高于OVASSAY被动浮选方法的诊断敏感性和特异性。尽管离心显著增加了粪便检查的敏感性,但由于被动浮选比较方便,其仍然是兽医私人诊所中最常用的技术[10,19,36,51,56-58]。鉴于VETSCAN IMAGYST系统能可靠地检出和检测粪便样本中的寄生虫成分,在很大程度上不依赖于检查者的经验水平,并且之前已证明VETSCAN IMAGYST离心浮选法可在约10分钟内提供结果[40],因此有可能替代在兽医实践中使用的传统被动浮选方法。
VETSCAN IMAGYST系统最独特的特点是其深度学习客观检测算法。据我们所知,VETSCAN IMAGYST系统是集成深度学习客观检测算法并应用于兽医学的唯一自动诊断系统。与没有任何关于待学习功能的结构信息的浅层学习系统相比,深层学习算法在分层层次结构的每层均具有局部优势,使得系统能忽略使计算机视觉变弱的方面[59,60]。分层层次结构还有助于系统连续适应新数据,并将这些数据应用于示例较少的新输出类别[60,61]。深度学习特征以及结合本地化和分类特征的YOLOv3客观检测模型[43]使背景误差降低,且VETSCAN IMAGYST系统和专家检查之间具有高一致性。该系统的另一个优点是能够在安全、基于云的服务器系统上存储图像和报告,允许寄生虫学家以及兽医和学术团体成员轻松共享患病动物护理、研究和教学信息。
本研究未评价VETSCAN IMAGYST系统的可用性;然而,我们以前的分析表明,采用VETSCAN IMAGYST离心浮选法的VETSCAN IMAGYST系统可在10分钟左右产生结果,这与常规粪便浮选试验相当。该时间范围包括约3.5分钟制备样本的时间(包括2分钟离心孵育时间)和约6-7分钟扫描图像的时间[40]。本研究的数据进一步证明VETSCAN IMAGYST系统检测从粪便样本中检出的肠道寄生虫成分的性能。除了鉴别原生动物寄生虫-等孢子球虫和贾第鞭毛虫外,我们目前和以前的研究结果表明,该系统在犬和猫中检测4个不同属/组胃肠道寄生虫(钩虫、蛔虫、鞭虫、绦虫)具有可靠的性能[40]。经过进一步训练,VETSCAN IMAGYST系统将获得鉴别其他寄生虫的能力。VETSCAN IMAGYST系统的定量能力目前正在开发中。预计该算法将能够在未来进行粪便虫卵计数检测。
5、结论
VETSCAN IMAGYST系统可有效检出并鉴别猫和犬粪便样本中的猫钩虫卵、猫弓首蛔虫卵、等孢子球虫卵囊和贾第鞭毛虫包囊。鉴于VETSCAN IMAGYST系统的深度学习性质,预期其性能会随着时间推移而改善,这使得兽医诊所能够准确有效地进行粪便检查。
致谢
作者感谢Dr.Ruth Scimeca和Emily Looper帮助制备粪便样本并读取浮选载玻片。作者还感谢参与本研究中犬和猫粪便样本采集的所有人员。感谢Litto Communications,LLC协助编写手稿。
作者贡献
YN进行粪便虫卵分析,并且是撰写手稿的主要贡献者。RHS、AD、AP、ML、CP、RG制定实验方案和分析数据,并对撰写手稿做出了贡献。TC进行了数据汇总和分析。BL和RBS对研究的技术执行和手稿审查做出了贡献。所有作者阅读并批准了最终手稿。
资助
本文报告的研究由硕腾公司资助。
数据和材料的可用性
本研究期间生成或分析的所有数据均包含在本发表文章中。
伦理批准和参加研究的知情同意
不适用。
同意出版
不适用。
利益冲突
RHS、AD、AP、ML、CP、RG和TC目前是硕腾公司的员工。BL和RBS目前是Techcyte的员工。开展本研究时,YN是俄克拉荷马州立大学的员工,目前是硕腾公司的员工。
作者详细信息
1俄克拉荷马州立大学兽医学院兽医病理学系,Stillwater,OK 74078,USA。
2硕腾公司兽药研发部,333 Portage Street, Kalamazoo, MI 49007, USA。
3硕腾公司全球诊断部,10 Sylvan Way, Parsippany, NJ 07054, USA。
4硕腾公司宠物护理部,10 Sylvan Way, Parsippany, NJ 07054, USA。
5Techcyte,Incorporated,384 S 400 W #125, Lindon, UT 84042, USA。
接收日期:2020年8月2日 收录日期:2021年1月11日
在线发表日期:2021日1月29日
参考文献
1. Animal Sheltering/the Humane Society of the United States, 2020. Pets by the numbers. https://www.animalsheltering.org/page/pets-by-the-numbers. Accessed 15 Apr 2020.
2. American Veterinary Medical Association (AVMA). Pet ownership stable, veterinary care variable. https://www.avma.org/javma-news/2019-01-15/ pet-ownership-stable-veterinary-care-variable Accessed 16 July 2020.
3. Hoggard KR, Jarriel DM, Bevelock TJ, Verocai GG. Prevalence survey of gastrointestinal and respiratory parasites of shelter cats in northeastern Georgia, USA. Vet Parasitol Reg Stud Rep. 2019;16:100270. https://doi. org/10.1016/j.vprsr.2019.100270.
4. Little S, Adolph C, Downie K, Snider T, Reichard M. High prevalence of covert infection with gastrointestinal helminths in cats. J Am Anim Hosp Assoc. 2015;51(6):359–64. https://doi.org/10.5326/JAAHA-MS-6221.
5. Lucio-Forster A, Bowman DD. Prevalence of fecal-borne parasites detected by centrifugal flotation in feline samples from two shelters in upstate New York. J Feline Med Surg. 2011;13(4):300–3. https://doi. org/10.1016/j.jfms.2010.12.013.
6. Nagamori Y, Payton ME, Duncan-Decocq R, Johnson EM. Fecal survey of parasites in free-roaming cats in northcentral Oklahoma, United States. Vet Parasitol Reg Stud Rep. 2018;14:50–3. https://doi.org/10.1016/j.vprsr.2018.08.008.
7. Nagamori Y, Payton ME, Looper E, Apple H, Johnson EM. Retrospective survey of parasitism identified in feces of client-owned cats in North America from 2007 through 2018. Vet Parasitol. 2020;277:109008. https:// doi.org/10.1016/j.vetpar.2019.109008.
8. Villeneuve A, Polley L, Jenkins E, Schurer J, Gilleard J, Kutz S, et al. Parasite prevalence in fecal samples from shelter dogs and cats across the Canadian provinces. Parasites Vectors. 2015;8:281. https://doi.org/10.1186/ s13071-015-0870-x.
9. Loftin CM, Donnett UB, Schneider LG, Varela-Stokes AS. Prevalence of endoparasites in northern Mississippi shelter cats. Vet Parasitol Reg Stud Rep. 2019;18:100322. https://doi.org/10.1016/j.vprsr.2019.100322.
10. Zajac AM, Conboy GA. Veterinary clinical parasitology. 8th ed. Ames, IA: Blackwell Publishing; 2012.
11. Companion Animal Parasite Council (CAPC), 2020. CAPC guidelines: hookworms. https://capcvet.org/guidelines/hookworms/. Accessed 21 Apr 2020.
12. Fisher M. Toxocara cati: an underestimated zoonotic agent. Trends Parasitol. 2003;19(4):167–70. https://doi.org/10.1016/s1471-4922(03)00027-8.
13. Furtado LFV, Dias LTO, Rodrigues TO, Silva VJD, Oliveira V, Rabelo EML. Egg genotyping reveals the possibility of patent Ancylostoma caninum infection in human intestine. Sci Rep. 2020;10(1):3006. https://doi.org/10.1038/ s41598-020-59874-8.
14. Lee AC, Schantz PM, Kazacos KR, Montgomery SP, Bowman DD. Epidemiologic and zoonotic aspects of ascarid infections in dogs and cats. Trends Parasitol. 2010;26(4):155–61. https://doi.org/10.1016/j.pt.2010.01.002.
15. Loukas A, Hotez PJ, Diemert D, Yazdanbakhsh M, McCarthy JS, Correa-Oliveira R, et al. Hookworm infection. Nat Rev Dis Primers. 2016;2:16088. https://doi.org/10.1038/nrdp.2016.88.
16. Macpherson CN. The epidemiology and public health importance of toxocariasis: a zoonosis of global importance. Int J Parasitol. 2013;43(12– 13):999–1008. https://doi.org/10.1016/j.ijpara.2013.07.004.
17. Taylor MA, Coop RL, Wall RL. Parasites of dogs and cats. In: Taylor MA, Coop RL, Wall RL, editors. Veterinary parasitology. West Sussex: Wiley; 2016. p. 599–677.
18. Bowman DD. Helminths. In: Bowman DD, editor. Georgis’ parasitology for veterinarians. St. Louis, Missouri: Elsevier Health Sciences; 2014. p. 122–240.
19. Gates MC, Nolan TJ. Endoparasite prevalence and recurrence across different age groups of dogs and cats. Vet Parasitol. 2009;166(1–2):153–8. https://doi.org/10.1016/j.vetpar.2009.07.041.
20. Hoopes JH, Polley L, Wagner B, Jenkins EJ. A retrospective investigation of feline gastrointestinal parasites in western Canada. Can Vet J. 2013;54(4):359–62.
21. Jacobs SR, Forrester CP, Yang J. A survey of the prevalence of Giardia in dogs presented to Canadian veterinary practices. Can Vet J. 2001;42(1):45–6.
22. Joffe D, Van Niekerk D, Gagne F, Gilleard J, Kutz S, Lobingier R. The prevalence of intestinal parasites in dogs and cats in Calgary Alberta. Can Vet J. 2011;52(12):1323–8.
23. Nagamori Y, Payton ME, Looper E, Apple H, Johnson EM. Retrospective survey of endoparasitism identified in feces of client-owned dogs in North America from 2007 through 2018. Vet Parasitol. 2020;282:109137. https://doi.org/10.1016/j.vetpar.2020.109137.
24. Olson ME, Leonard NJ, Strout J. Prevalence and diagnosis of Giardia infection in dogs and cats using a fecal antigen test and fecal smear. Can Vet J. 2010;51(6):640–2.
25. Wyrosdick HM, Chapman A, Martinez J, Schaefer JJ. Parasite prevalence survey in shelter cats in Citrus County, Florida. Vet Parasitol Reg Stud Rep. 2017;10:20–4. https://doi.org/10.1016/j.vprsr.2017.07.002.
26. Companion Animal Parasite Council (CAPC), 2020. Giardia prevalence. https://capcvet.org/maps/#2020/all/giardia/dog/united-states/ Accessed 19 July 2020.
27. Blagburn BL, Lindsay DS, Vaughan JL, Rippey NS, Wright JC, Lynn RC, et al. Prevalence of canine parasites based on fecal flotation. The compendium on continuing education for the practicing veterinarian (USA). 1996. https://www.researchgate.net/publication/279867899_Prevalence_of_canin e_parasites_based_on_fecal_flotation.
28. Jordan HE, Mullins ST, Stebbins ME. Endoparasitism in dogs: 21,583 cases (1981–1990). J Am Vet Med Assoc. 1993;203(4):547–9.
29. Little SE, Johnson EM, Lewis D, Jaklitsch RP, Payton ME, Blagburn BL, et al. Prevalence of intestinal parasites in pet dogs in the United States. Vet Parasitol. 2009;166(1–2):144–52. https://doi.org/10.1016/j.vetpa r.2009.07.044.
30. Nolan TJ, Smith G. Time series analysis of the prevalence of endopara-sitic infections in cats and dogs presented to a veterinary teaching hospital. Vet Parasitol. 1995;59(2):87–96. https://doi.org/10.1016/0304-4017(94)00742-u.
31. Stafford K, Kollasch TM, Duncan KT, Horr S, Goddu T, Heinz-Loomer C, et al. Detection of gastrointestinal parasitism at recreational canine sites in the USA: the DOGPARCS study. Parasites Vectors. 2020;13(1):275. https://doi.org/10.1186/s13071-020-04147-6.
32. Companion Animal Parasite Council (CAPC), 2020. CAPC Guidelines: Giardia. https://capcvet.org/guidelines/giardia/. Accessed 20 Apr 2020.
33. Little SE, Lindsay DS. Laboratory diagnosis of protozoal Infections. In: Sykes JE, Greene CE, editors. Infectious diseases of the dog and cat. 4th ed. St. Louis, Missouri: Elsevier; 2012. p. 711–5.
34. Kirkpatrick CE. Feline giardiasis: a review. J Small Anim Pract. 1986;27(2):69–80. https://doi.org/10.1111/j.1748-5827.1986.tb02124.x.
35. McHardy IH, Wu M, Shimizu-Cohen R, Couturier MR, Humphries RM. Detection of intestinal protozoa in the clinical laboratory. J Clin Microbiol. 2014;52(3):712–20. https://doi.org/10.1128/JCM.02877-13.
36. Dryden MW, Payne PA, Ridley RK, Smith VE. Gastrointestinal parasites: the practice guide to accurate diagnosis and treatment. Suppl Compend Contin Educ Vet. 2006;28:8.
37. Ballweber LR, Beugnet F, Marchiondo AA, Payne PA. American Association of Veterinary Parasitologists’ review of veterinary fecal flotation methods and factors influencing their accuracy and use—is there really one best technique? Vet Parasitol. 2014;204(1–2):73–80. https://doi.org/10.1016/j. vetpar.2014.05.009.
38. Gates MC, Nolan TJ. Comparison of passive fecal flotation run by veterinary students to zinc-sulfate centrifugation flotation run in a diagnostic parasitology laboratory. J Parasitol. 2009;95(5):1213–4. https://doi. org/10.1645/GE-2058.1.
39. Inacio SV, Ferreira Gomes J, Xavier Falcao A, Nagase Suzuki CT, Bertequini Nagata W, Nery Loiola SH, et al. Automated diagnosis of canine gastrointestinal parasites using image analysis. Pathogens. 2020;9:2. https://doi. org/10.3390/pathogens9020139.
40. Nagamori Y, Hall Sedlak R, DeRosa A, Pullins A, Cree T, Loenser M, et al. Evaluation of the VETSCAN IMAGYST: an in-clinic canine and feline fecal parasite detection system integrated with a deep learning algorithm. Parasites Vectors. 2020;13(1):346. https://doi.org/10.1186/s13071-020-04215-x.
41. Scare JA, Slusarewicz P, Noel ML, Wielgus KM, Nielsen MK. Evaluation of accuracy and precision of a smartphone based automated parasite egg counting system in comparison to the McMaster and Mini-FLOTAC methods. Vet Parasitol. 2017;247:85–92. https://doi.org/10.1016/j.vetpa r.2017.10.005.
42. Slusarewicz P, Pagano S, Mills C, Popa G, Chow KM, Mendenhall M, et al. Automated parasite faecal egg counting using fluorescence labelling, smartphone image capture and computational image analysis. Int J Parasitol. 2016;46(8):485–93. https://doi.org/10.1016/j.ijpara.2016.02.004.
43. Redmon J, Farhadi A. YOLOv3: an incremental improvement. arXiv preprint. 2018;1804.02767. https://pjreddie.com/media/files/papers/YOLOv 3.pdf.
44. Kingma DP, Ba JL. ADAM: a method for stochastic optimazation. arXiv preprint. 2017;1412.6980. https://arxiv.org/pdf/1412.6980.pdf.
45. Zoetis, OVASSAY plus kit fecal flotation device, https://www.zoetisus. com/products/diagnostics/OVASSAY -plus-kit-fecal-flotation-devic es.aspx.
46. MacDonald ML, Rogers QR, Morris JG. Nutrition of the domestic cat, a mammalian carnivore. Annu Rev Nutr. 1984;4:521–62. https://doi. org/10.1146/annurev.nu.04.070184.002513.
47. Salaun F, Blanchard G, Le Paih L, Roberti F, Niceron C. Impact of macronutrient composition and palatability in wet diets on food selection in cats. J Anim Physiol Anim Nutr (Berl). 2017;101(2):320–8. https://doi. org/10.1111/jpn.12542.
48. European Scientific Counsel Companion Animal Parasites (ESCCAP), 2018. Control of intestinal protozoa in dogs and cats. https://www.escca p.org/uploads/docs/xnqpgri2_0701_ESCCAP_Guideline_GL6_v7_1p.pdf. Accessed 20 Apr 2020.
49. Companion Animal Parasite Council (CAPC), 2020. General guidelines. https://capcvet.org/guidelines/general-guidelines/ Accessed 27 July 2020.
50. Kirkpatrick CE. Giardiasis. Vet Clin North Am Small Anim Pract. 1987;17(6):1377–87. https://doi.org/10.1016/s0195-5616(87)50007-9.
51. Zajac AM, Johnson J, King SE. Evaluation of the importance of centrifugation as a component of zinc sulfate fecal flotation examinations. J Am Anim Hosp Assoc. 2002;38(3):221–4. https://doi.org/10.5326/0380221.
52. Garcia LS, Arrowood M, Kokoskin E, Paltridge GP, Pillai DR, Procop GW, et al. Laboratory diagnosis of parasites from the gastrointestinal tract. Clin Microbiol Rev. 2018. https://doi.org/10.1128/CMR.00025-17.
53. Rishniw M, Liotta J, Bellosa M, Bowman D, Simpson KW. Comparison of 4 Giardia diagnostic tests in diagnosis of naturally acquired canine chronic subclinical giardiasis. J Vet Intern Med. 2010;24(2):293–7. https://doi. org/10.1111/j.1939-1676.2010.0475.x.
54. Kochanowski M, Dabrowska J, Karamon J, Cencek T, Osinski Z. Analysis of the accuracy and precision of the McMaster method in detection of the eggs of Toxocara and Trichuris species (Nematoda) in dog faeces. Folia Parasitol (Praha). 2013;60(3):264–72. https://doi.org/10.14411/fp.2013.030.
55. Egwang TG, Slocombe JO. Evaluation of the Cornell-Wisconsin centrifugal flotation technique for recovering trichostrongylid eggs from bovine feces. Can J Comp Med. 1982;46(2):133–7.
56. Broussard JD. Optimal fecal assessment. Clin Tech Small Anim Pract. 2003;18(4):218–30. https://doi.org/10.1016/S1096-2867(03)00076-8.
57. Dryden MW, Payne PA, Ridley R, Smith V. Comparison of common fecal flotation techniques for the recovery of parasite eggs and oocysts. Vet Ther. 2005;6(1):15–28.
58. O’Grady MR, Slocombe JO. An investigation of variables in a fecal flotation technique. Can J Comp Med. 1980;44(2):148–57.
59. Krizhevsky A, Sutskever I, Hinton G. ImageNet classification with deep convolutional neural networks. In NeurIPS. 2012. https://papers.nips. cc/paper/4824-imagenet-classification-with-deep-convolutional-neura l-networks.pdf
60. Poggio T, Mhaskar H, Rosasco L, Miranda B, Liao Q. Why and when can deep-but not shallow-networks avoid the curse of dimensionality: a review. Int J Autom Comput. 2017;14(5):503–19. https://doi.org/10.1007/ s11633-017-1054-2.
61. Yosinski J, Clune J, Bengio Y, Lipson H. How transferable are features in deep neural networks? In: Advances in sneural information processing systems. 2014. https://arxiv.org/pdf/1411.1792.pdf.