
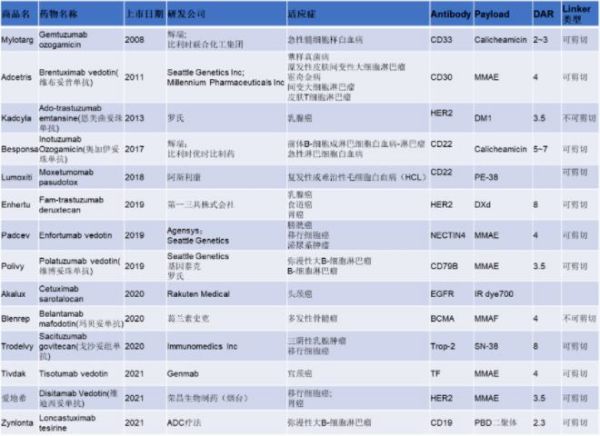
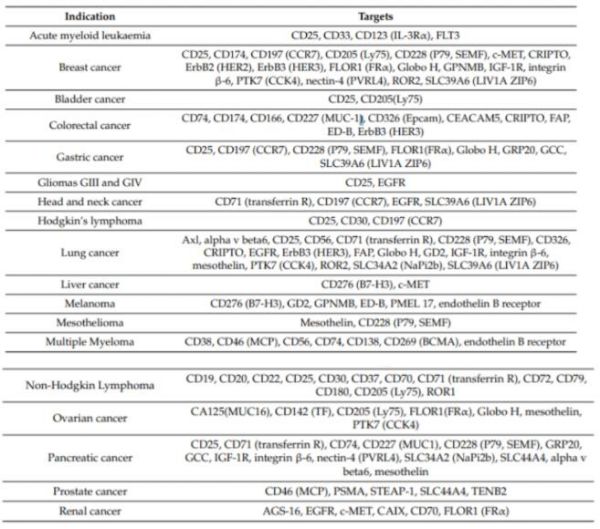
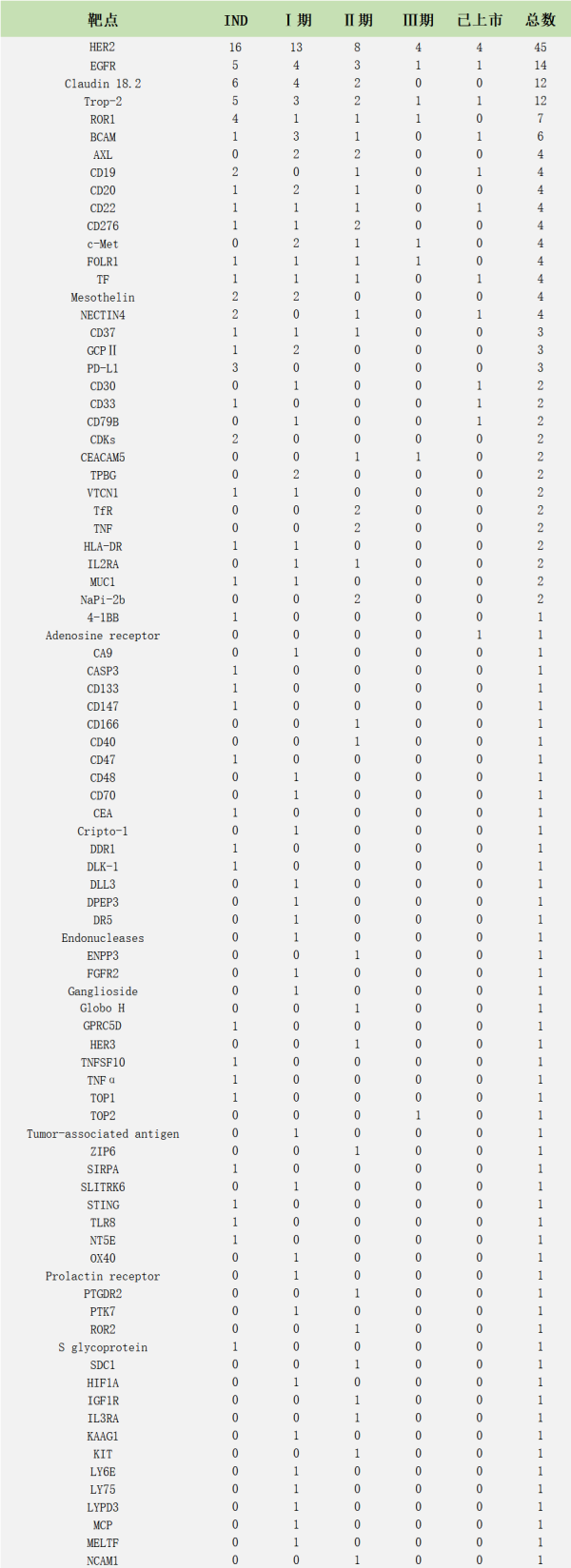
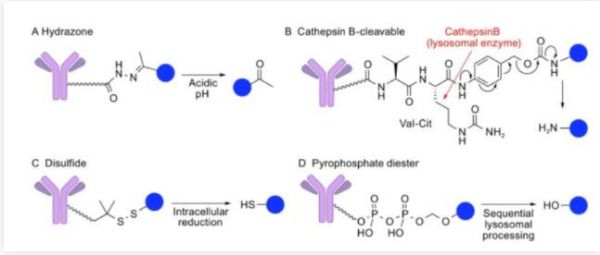
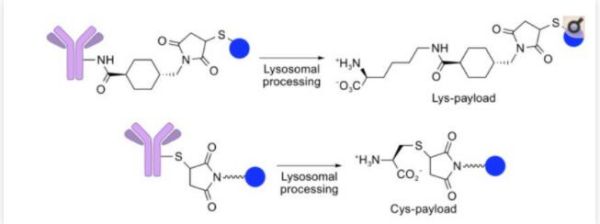
抗体偶联药物(Antibody-drug conjugates, ADC)由靶向疾病特异性抗原的抗体(Antibody)与有细胞毒性的小分子药物(Payload)通过连接子(Linker)偶联组成。 小分子化疗药物是治疗肿瘤一种重要治疗手段,但是它对肿瘤细胞(或组织)特异性差,对正常组织细胞的杀伤大,常出现不良反应。但是ADC药物可以借助抗体的靶向作用,将小分子化疗药物靶向到肿瘤细胞(或组织)表面,形成ADC-抗原复合物,被肿瘤细胞内吞,进而经过溶酶体降解,细胞毒素在胞内释放,在不杀伤正常细胞的情况下,发挥杀伤肿瘤的作用。 ADC想法最早于1913年由德国诺贝尔生理与医学奖得主Paul Ehrlich提出。1983年第一款ADC药物(抗癌胚抗原抗体-长春地辛)正式进入临床试验。患者注射该ADC药物后,抗肿瘤活性未下降,但是限制药物的全身循环,降低全身毒副作用,从而提高治疗价值。 目前,ADC药物主要用于肿瘤的治疗。另外其也在尝试治疗其他疾病领域:动脉粥样硬化、细菌血症和炎症性疾病等。 图1.ADC作用机制[1] 01 ADC历史 图2:(摘自《医药行业抗体偶联药物(ADC)行业专题》·中信证券) 1. 第一代ADC药物以靶向CD33的Mylotarg(2008年批准辉瑞Gemtuzumab ozogamicin治疗急性髓细胞样白血病)为代表性药物,使用鼠源抗体,免疫原性较强,易产生人抗鼠抗体;连接子不稳定,毒素在血浆中提前 释放导致严重的毒性反应;细胞毒素药物效力不足,不足以杀死肿瘤细胞。 2. 第二代ADC药物以靶向CD30的Adcetris(Seattle Genetics Inc2011年上市研发的Brentuximab vedotin,适应症:蕈样真菌病; 原发性皮肤间变性大细胞淋巴瘤; 霍奇金病等)和靶向HER2的Kadcyla(基因泰克研发的Ado-trastuzumab emtansine恩美曲妥珠单抗2013年上市治疗乳腺癌,卵巢癌及其转移癌)为代表,使用人鼠嵌合抗体、人源化单抗代替鼠源单抗,采用了毒性更高的细胞毒素和更稳定的连接子,但药物/抗体比率(DAR)不均一,循环中的未结合细胞毒素的裸抗占比较多,竞争偶联药物抗原结合位点,降低了疗效;此外,药物过多的与抗体结合易引起抗体聚集、清除速度加快、非特异性毒性增加等问题。 3. 第三代ADC药物得益于定点偶联技术的发展,可将DAR值稳定在2-4左右,稳定性和药代动力学得到改善;同时利用可剪切连接子发挥旁观者效应(疏水性小分子毒素还可以通过细胞膜扩散,对邻近肿瘤细胞产生杀伤活性,称为“旁观者效应”),提升了疗效,降低了毒性反应,代表药物为靶向HER2的Enhertu(第一三共研发与阿斯利康合作Fam-trastuzumab deruxtecan2019年上市,治疗乳腺癌,食道癌,胃癌等)。 据不完全统计,目前全球上市的ADC药物有14款,我国上市的有4款,包括荣昌生物研发的爱地希(2021年上市,国内首创),辉瑞的Besponsa,罗氏的Kadcyla,西雅图基因的Adcetris。涉及的靶点有CD33, CD30, HER2, CD22, NECTIN4,CD79B, EGFR, BCMA, Trop-2, TF, CD19。 图3.上市ADC盘点 02 技术难点 靶向性:Antibody的高特异性,内吞作用,影响ADC的靶向性 安全性:Linker的精准切割、高均一性,影响ADC的安全性 抗肿瘤活性:Payload的高毒性、高稳定性,影响ADC的抗肿瘤活性 1.Antibody:ADC的抗体选择 (1)能与靶细胞高特异性结合的抗体。例如,p97受体在黑色素瘤细胞上高表达(80000-280000个受体/细胞),而其他细胞上p97受体低表达,因此ADC药物L49-vcMMAF对黑色素瘤细胞有高特异性。 (2)ADC与抗原结合后,可被充分内化入细胞内。不充分或低效的内吞,会增加肿瘤细胞外细胞毒性分子不适当的释放。 (3)ADC对靶抗原上的表位有高亲和力。这也是影响ADC内化的因素之一。 目前已超过 50 种不同的抗体被开发成ADC药物。根据不同疾病靶点统计如下: 图4.在研与上市的ADC针对不同疾病选用的抗体[2] ACROBiosystems可提供ADC药物:①多种高质量靶点蛋白;②分子互作服务;③用于Linker酶切的Cathepsin/MMP/PLAU;④抗小分子药物抗体和抗独特型抗体及开发服务便于ADC 耐药性研究。点击文章最下方“阅读全文”,查看应用案例。 另外,小编还统计了225个已上市和在研的ADC药物,按照不同抗体开发的ADC药物的数量进行排列。 2. Linker:3个标准 (1)稳定性:ADC药物在血流循环中,细胞毒性药物与抗体紧密结合,Linker不过早断裂。Linker的不稳定性导致细胞毒性药物过早释放,会对非靶细胞(正常细胞)造成损伤,从而导致全身毒性和不良反应。 (2)及时释放:当ADC药物被内吞入肿瘤细胞后,Linker可在溶酶体中及时断裂,并释放出有细胞毒性的药物。 (3)防聚集:疏水的Linker会与疏水性的细胞毒性药物形成团聚,团聚的蛋白质会在积聚在肝脏的RES(网状内皮系统),造成肝脏毒性,此外,团聚的蛋白质很可能作为免疫原物质引起全身的免疫反应。目前,常用含负电荷磺酸盐基团的亲水性Linker、PEG或焦磷酸二酯基解决这个问题。 分类:大致可分为可切割和不可切割Linker。 可切割Linker: (1)酸性不稳型:腙键在血液pH(7.4)下稳定,在酸性环境下裂解; (2)氧化还原依赖型:二硫键,通过与细胞内硫醇(如谷胱甘肽)的二硫交换被切割; (3)可酶切型:肽类和β-葡萄糖醛酸酯型,这两类Linker可被溶酶体内的水解酶切割。 但是临床上可切割Linker在血液循环中都有不同程度释放,导致全身毒性, Mylotarg(腙键连接)因毒性较高撤出市场。 不可切割Linker:硫醚键(代表性药物Kadcyla)的优势在于血液环境中更加稳定,仅在溶酶体中切割释放细胞毒,安全性明显更好。然而不可切割Linker通常会残留在细胞毒素上,影响其杀伤活性及细胞穿透性。因而对周围的异质性肿瘤细胞杀伤作用有限,不能充分发挥旁观者效应。 3. Payload:细胞毒素 第一代ADC药物开发选用了临床上常用的化疗毒性药物,包括多柔比星、甲氨蝶呤、丝裂霉素、氟尿嘧啶及长春碱等。这些化疗药物肿瘤杀伤效果较弱,且IC50值过大(mM级别),且缺乏选择性,在靶细胞内积聚少。 新一代的细胞毒性药物被开发,其IC50值在次nM级别。目前临床上ADC药物所用的细胞毒性药物主要作用于DNA和微管蛋白。 (1)靶向DNA:卡奇霉素calicheamicin、多卡霉素duocarmycin,及吡咯并苯二氮䓬类(PBDs)、伊利替康、SN-38 和 DXd。 卡奇霉素类ADC药物(例如Inotuzumab ozogamicin和Gemtuzumab ozogamicin)与DNA的小沟结合并诱导DNA双链断裂,引起细胞凋亡 多卡霉素在血浆中易降解,故常将其无活性的前药设计成ADC药物。seco-duocarmycin-hydroxybenzamide-azaindole (seco-DUBA)内吞入靶细胞后,释放出多卡霉素。多卡霉素可与DNA小沟上富含A-T区域结合,引起DNA损伤,最终导致细胞凋亡 PBDs是一种DNA烷化剂,其单体可与DNA小沟的鸟嘌呤残基结合,而PBDs作为PBD的二聚体,可在DNA链内或链间形成连接,使得DNA无法扭曲,从而杀伤肿瘤细胞 伊利替康(CPT-11)是DNA拓扑异构酶Ⅰ抑制剂,可抑制DNA复制引起细胞死亡 SN-38(Sacituzumab govitecan中的细胞毒性药物)是伊利替康的生物活性代谢产物,也是DNA拓扑异构酶Ⅰ抑制剂 DXd(Exatecan衍生物)是一种拓扑异构酶 I 抑制剂。其杀伤肿瘤的活性是SN-38的10倍 (2)微管蛋白抑制剂:奥利斯他汀类Auristatins和美登素类Maytansinoids。 奥利斯他汀类是natural agent dolastatin 10(从海兔中提取的天然化合物)的类似物,可以抑制微管蛋白的聚合,抑制细胞分裂。44%的获批ADC药物都选用奥利斯他汀类作为其细胞毒性药物。例如MMAE(Monomethyl auristatin E)是Adcetris,Padcev,Polivy,Tivdak,爱地希这些上市的ADC药物的Payload。 美登素类为天然生物碱,1972年从卵叶美登木中提取,其通过抑制微管蛋白解聚,抑制有丝分裂过程中纺锤体的形成,具有极强的抑制肿瘤细胞增殖的能力。罗氏已上市的Kadcyla就采用了美登素类作为Payload。 ADC药物结合了单抗药的靶向性和小分子化疗药的杀伤性,且降低了两者的毒副作用,是抗肿瘤领域的“生物导弹”。其经过数十年的迭代,技术不断优化,临床治疗潜力巨大。 Adcetris和Kadcyla(被NCCN指南列为HER2阳性乳腺癌二线首选方案)的问世给CD30阳性淋巴瘤患者和HER2阳性实体瘤患者带来新希望。多款已上市ADC药物相比于已有的治疗方案都展现出出色的治疗效果。但是,ADC的研发并不是一帆风顺的。Mylotarg(第一个FDA批准的ADC药物),用于治疗阳性急性髓性白血病(AML)的ADC由于在验证III期临床研究中未能证实临床收益,并发现了具有致死的毒性,于2010年被辉瑞撤市。一直到2017年,辉瑞调整给药剂量和治疗方案,Mylotarg才又一次被批准上市。 但是Mylotarg上市的曲折,并没有打击对ADC的研发信心。目前我国的ADC研发虽然起步较晚,但是自主研发能力强。尤其是2021年荣昌生物的爱地希顺利上市,给国内的ADC企业带来信心。 参考文献: [1] Tsuchikama K , An Z . Antibody-drug conjugates: recent advances in conjugation and linker chemistries[J]. Protein & Cell, 2018, 9(1). [2] Hafeez U , Parakh S , Gan H K , et al. Antibody–Drug Conjugates for Cancer Therapy[J]. Molecules, 2020, 25(20):4764. Webinar 第92期 专栏:阿诺医药——差异化临床专栏 2018年毕业于中国科学院,并获得博士学位。毕业后从事抗肿瘤免疫研究、新药研发工作,先后在国内知名科研单位和生物医药公司任职,具备抗体和靶向小分子等多种类型药物开发经历,涉及领域集中在抗肿瘤创新药研发。 阿诺医药是一家临床阶段的专注于创新型肿瘤药物开发的全球性生物制药公司,在中美两地均设有研发及临床运营中心。阿诺医药通过“联合创新”和“自主研发”的模式构建起多个全球化的产品管线,目前涵盖10余种抗肿瘤候选药物,其中有4款药物现处于临床阶段。 阿诺医药已组建了一支经验丰富的管理团队,并搭建了专有的药物研发平台,同时与全球多家领先制药企业建立了战略合作关系。阿诺医药致力于成为打造“全球新”肿瘤药物的创新型研发企业,为中国乃至全球患者带来更有效的治疗方式,实现将癌症变成一种慢性疾病乃至治愈的使命。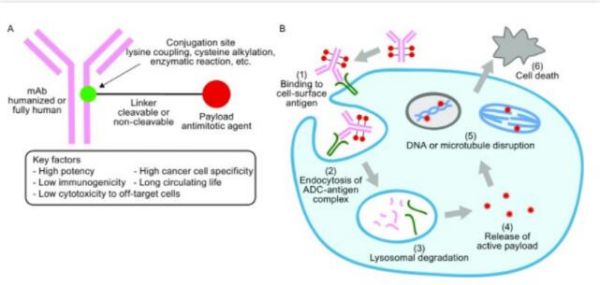




)
