
第三届全球生物医药前沿技术大会会议现场
2021年7月11日下午,同济大学附属东方医院李进教授在同写意主办的第三届全球前沿技术大会上做了题为《中国抗肿瘤药物研发现状与挑战》的报告,本文根据现场速记整理,未经李进教授审核。

-01-
最近大家都很关注一些新的政策变化,我从临床医生的角度谈谈近期CDE出台的政策,可能会对未来的新药研发有很大帮助。
最近股市重大的好消息就是医药股闪崩。因为大浪淘沙,使劲下跌会把那些专门做仿制药和Me too的企业灭了。中国真正的创新企业能走上前台,让他们开发真正的新药创制产品,走向全世界。
这对中国是重大的利好消息!
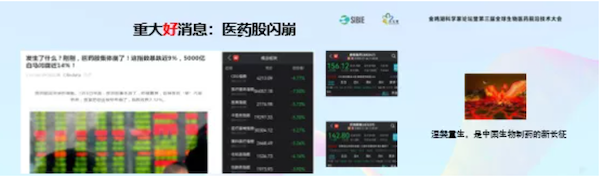
从上图看到,这次股市的变化体现了国家近期的指导原则颁布之后对新药创制的思维和理念的改变。
这种改变是涅槃重生,是中国生物制药从仿制到创制、到创新的一个必要的过程。
股市反应了社会对临床药物的需求,也体现出社会经济发展到了一个重要的关头。
-02-
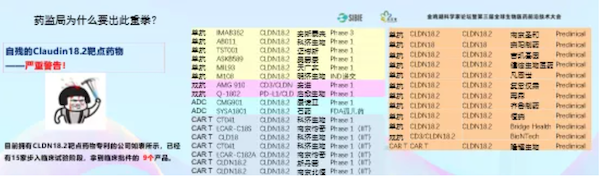
大家都看到做PD-1和PD-L1单抗的有87家,而声称自己有PD-1和PD-L1的就有将近180多家,在这种情况下我们必须出台一些政策来给予纠正。
除了PD-1/PD-L1,还有Claudin18.2,就那么一点胃癌和胰腺癌,没有多少病人。但是正在开发的、已经拿到批准的,和正在准备申报的,将近18家。
这种情况要引起大家的高度警惕。这个时候还要去做这个靶点的单抗、双抗和CAR-T,那最后一定都死得很惨,就像今天的PD-1的白菜价一样。
举个恒瑞的例子。两三周前恒瑞医药50周年庆的时候,就已经把Claudin18.2终止了。希望今天在座的企业如果还有在做的就别做了,可能做了也是白做。

中国药促会去年成立了药促会肿瘤临床研究专委会,在成立大会上我代表大家承诺出台中国的抗肿瘤药物的警示报告。这个报告会在7月底出台,把中国所有创新靶点的现状和国际研发现状都给大家做详细介绍。
希望这样的举措能对中国的新药创制有所帮助。

除了Claudin18.2,还有很多类似的靶点都是大家挤在一个赛道上,如果几十个产品在竞争,打得头破血流的,这有价值吗?看看上图,FGFR现在全国有多少,所以目前在同靶点上如果大家要去做的话,最好先做好调研。
做临床研究跟做科学一样,要有科学性、先进性和可行性,在座的其实科学性都没有问题,但是希望大家重视先进性,做到人无我有。你做的靶点的药物要做到真正的frist-in-class,真正的only-in-class。
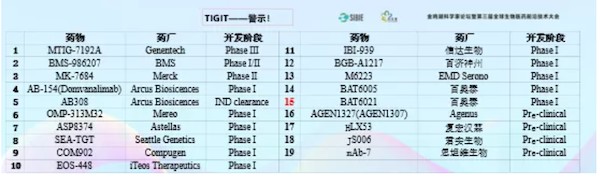
还有TIGIT这个靶点也特别热。举这几个例子给大家看一下现在热到什么程度。上图中每个生物制药企业都有各种各样的双抗,后面会给大家讲双抗不是不能做,其实双抗在未来发展中非常重要的克服耐药,或者提高过去免疫检查点抑制剂的疗效。那么进一步发展到免疫检查点抑制剂2.0,双抗是不是有效呢?还真不一定,几个双功能单抗的失败应该引起大家的重视。
-03-


-04-

这次CDE出台的征求意见稿,提出以临床获益和临床价值为核心。什么是以临床价值为核心?其实就两条:
第一,要做头对头的随机对照临床研究。跟谁做头对头?当然是跟美国比,如果不跟美国比,跟缅甸和越南比,那不是真正的“头对头”。药物研制的“头对头”要拿目前最好的标准治疗做对照,这才是我们今天需要做的。
因为病人签了知情同意书之后参加临床试验就没有其他的选择,不能做其他任何的治疗,医生给他什么治疗就必须做什么治疗,所以从伦理角度也应该为病人提供最好的治疗。病人把性命都交给我们了,我们为什么不给病人提供最好的治疗,而找一个很差的治疗来显示我们这个实验组有效?这不人道,也没有良心。
我非常赞同CDE出台的政策,用最佳治疗方式/药物作你的对照组,你所研究的方法/药物一定要比现在的标准治疗更好,才能有价值上市。这对我们在座的各位提出了更高的要求。这是时代的进步!
第二,如何做单臂?以临床价值为导向的临床试验再次强调单臂只适合无标准治疗可选择的末线治疗。如果有标准治疗,让病人做单臂就害了他。
只有疗效突出的药物才适合做单臂,大家可能问一个标准治疗有很好疗效,达到60%,那我这个疗效也是60%,也很有效,能不能做单臂呢?不行,只有疗效突出的才适合做单臂。
“疗效突出”,就是跟现在的标准治疗比较,疗效突出。如果现在的标准治疗是有效率30%,那你必须50%-60%;如果现在的标准治疗是50%,那你必须80%;如果现在疗效已经90%了,你必须比它做得更好,做到100%或者99.9%才能上市,否则上市的机会可能会少。这就给中国新药创制提出更高的要求。
-05-
如果没有核心竞争力,中国的新药创制往哪儿走?每一个企业都要认真想想贵公司的核心竞争力到底在哪里?
1.双抗
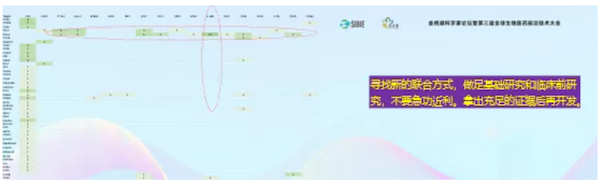
再来看看双抗,靶点全部集中在PD-1和PD-L1。大家挤在一个赛道上不是好事,应该寻找新的联合方式,做足基础研究和临床前研究,不要急功近利,拿出充足的证据证明有效性后再做临床开发。
2.细胞治疗
细胞治疗的未来充满希望,但是看看上图,细胞治疗有15个靶向CD19,能有多少病人CD19阳性?所以要开发不同的靶点和方式,包括CAR-NK。
科学家们要去发现更多精准的靶点蛋白来做CAR-T和CAR-NK。没有基础研究科学的成功,就没有新药创制的成功。希望大家多跟大学的科学家合作,踏踏实实地去做基础研究。
3.开发新靶点

肿瘤细胞有三百多个基因跟肿瘤的发生发展有关,我们现在开发的靶点只有十几个,能不能开发更多的靶点?
-06-
政府要有风险防范的顶层设计,企业要有防范风险的意识。这次CDE出台的新政降低了生物制药行业的风险。
中国个别企业专门挖社会主义“墙脚”,专门祸害中国新药创制。他搞一女嫁三夫,一个药一个靶点设计五个不同的分子卖给不同的厂家,这样搞怎么可能有中国的新药创制?
药物开发如何预防踩雷?企业研发能力不强,可以买进,但是它的科学性、先进性、可行性,最重要的是独创性要有。你买进的时候要把合同签好,我买你这个产品是不是全世界唯一的?如果是唯一的,我就付钱;如果我发现不是唯一的,你还卖给第二家了,对不起你药双倍或者三倍赔给我。要有这样的措施遏制一女嫁二夫的行为。
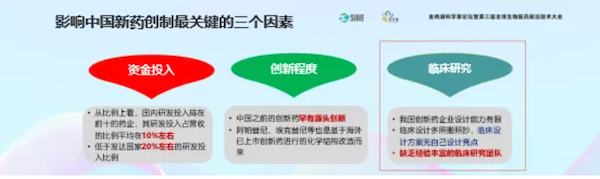
中国的新药创制有三个重要的影响因素:资金、创新和临床研究。重点讲临床研究。最近发现好几个产品到了CDE结果不批准,因为临床研究质量太差。
所以大家一定要小心找PI,一定找认真负责的PI。也许这个PI不一定特别有名,但是他要认真负责,要非常科学,你才能找他做。否则报批失败了,几个亿打水漂。
-07-
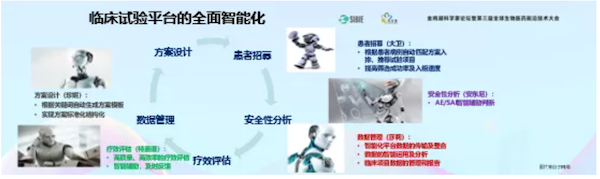
为了推进中国的新药创制,我们做了全智能化的临床试验平台。这个平台把所有流程,从医生写病史开始,一直到病程记录,到数据核查,全部用人工智能的方式来解决。

平台不断突破临床研究承载的上限,我们在研有130多项研究Ⅰ期临床。如果按照过去,只有十几个医生根本没法做这么多临床研究,起码要一百多个医生才能把这些做完。就是因为我们用了这套智能化系统,才可以承载这么大的工作量。
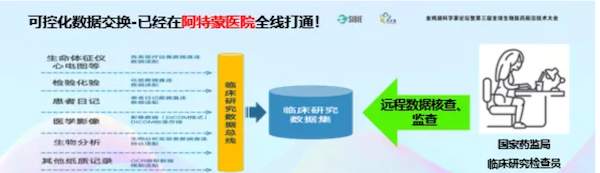
我们把医院里面所有系统的所有数据整合,可控化数据交换已经把流程打通,直接进入数据库,不需要双人录入。
这个数据库放在医院里,国家CDE的官员和CRA在家里就可以监控,或者做数据核查。这样减轻了很多公司成本,CRA再也不用报销差旅费。希望通过我们的工作加快临床研究的速度。
人工智能系统上线之后,我做一个郑重的承诺:
1.免费提供Ⅰ期临床试验方案撰写服务;
2.影像学评估报告48小时内完成;
3.Ⅰ期爬坡试验一年内完成,如因我方原因延期,赔款10万元/月;
4.如果因为临床研究质量问题导致药物不能获批,临床研究费用全赔。
我们要用实际行动帮助我们的企业加快研发速度,为中国的新药创制做出我们的贡献。

最后,看一看2020年全球Top20药企榜单,没有一家中国药企上榜。希望五年以后的榜单上能有中国药企的名字,这就要看中国药企未来的表现!
谢谢大家!